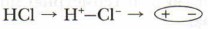|
|
|
|
|
Глава 9. Строение вещества § 45. Виды ковалентной связи и её свойства
Ковалентная связь устанавливается между атомами не только одного элемента, но и разных элементов с близкими значениями их электроотрицательности и близкими химическими свойствами. Примером таких соединений могут служить молекулы фторида и хлорида водорода, воды, аммиака, оксида углерода (IV) и др. Рассмотрим установление химической связи между атомами разных элементов-неметаллов на примере образования фторида водорода. Запишем схему электронных структур атомов водорода и фтора. У каждого из атомов имеется по одному неспаренному электрону. При взаимодействии этих электронов может образоваться общая электронная пара, связывающая атомы разных элементов. Связывающая их электронная пара принадлежит обоим атомам.
Эта химическая связь также ковалентная. Она осуществляется общей электронной парой, для образования которой каждый из этих атомов поставляет по одному электрону. С помощью ковалентной связи образуются молекулы многих сложных веществ, состоящие из нескольких атомов, например молекулы воды, аммиака и др. Сравним между собой характер ковалентной связи в молекулах простых и сложных веществ. В молекулах простых веществ Н2, O2, Cl2, N2, между собой связаны атомы одного и того же элемента с одинаковой электроотрицательностью, поэтом)' взаимодействующие атомы в равной степени притягивают к себе связывающую их электронную пару, и она оказывается одинаково удалённой от центров ядер обоих атомов. Эта связь является ковалентной неполярной.
В сложных веществах общие электронные пары связывают атомы разных элементов, имеющих разную электроотрицательность. В этом случае электронная пара (пары) смещена в сторону более электроотрицательного элемента, например в молекуле фторида водорода она смещена к атому фтора Н → F. Связывающая атомы электронная пара (пары) располагается асимметрично относительно их ядер. Вследствие этого ковалентная связь становится полярной. У более электроотрицательного элемента скапливается избыток отрицательного заряда, у менее электроотрицательного — избыток положительного заряда. Чем больше различается ОЭО взаимодействующих атомов, тем больше смещена общая электронная пара к наиболее электроотрицательному атому, тем полярнее химическая связь между атомами.
Молекулы хлороводорода, воды, аммиака также являются полярными. Их ещё называют диполями (имеющими два полюса):
|
|
|



 Чем отличаются ковалентные связи в простых и сложных веществах?
Чем отличаются ковалентные связи в простых и сложных веществах?

 Химическая связь между атомами одного элемента в простом веществе, осуществляемая общей электронной парой (парами), расположенной на равном удалении от ядер обоих связывающихся атомов, называется ковалентной неполярной.
Химическая связь между атомами одного элемента в простом веществе, осуществляемая общей электронной парой (парами), расположенной на равном удалении от ядер обоих связывающихся атомов, называется ковалентной неполярной.