|
|
|
|
|
Глава 1. Химические реакции и закономерности их протекания § 1. Энергетика химических реакцийВ курсе химии 8 класса вы познакомились с различными химическими реакциями, их классификациями и уравнениями, а также законами, которым они подчиняются. Цель изучения химических реакций на данном этапе — продолжить накопление знаний о них, о закономерностях их протекания, чтобы активно использовать эти знания для самостоятельного объяснения и предсказания реакций электролитов, металлов и неметаллов, для раскрытия химизма изучаемых производств. Для этого важным является выяснение вопросов: почему и как происходят химические реакции?
Запишите уравнение реакции оксида кальция с водой, дайте ее характеристику. Как объяснить на примере химических реакций закон сохранения массы веществ? В природе постоянно происходят различные явления (физические, химические, геологические, биологические и др.). Их изучением занимаются естественные науки. Химические явления (реакции) изучает наука химия, поэтому химические реакции — важнейший объект ее познания. Химические реакции всегда непосредственно связаны с веществами, с которыми они происходят. Взаимосвязь веществ и химических реакций отражена в определении химии.
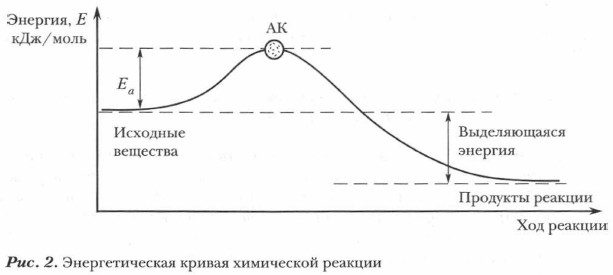
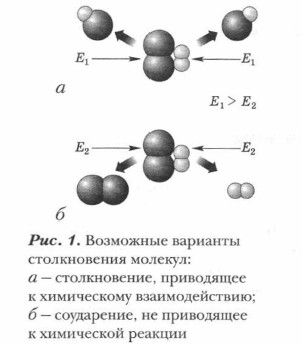
Суть химической реакции заключена в превращении исходных веществ (реагентов) в продукты реакции. Проблема. Всегда ли между веществами происходят химические реакции? Какие условия необходимы для их возникновения и протекания? Выясним условия, необходимые для возникновения реакций. Каждое вещество как химическая система обладает внутренней энергией. Она включает в себя кинетическую энергию образующих ее частиц (молекул, атомов, ионов) и потенциальную энергию их возможных взаимодействий между собой. Чтобы произошла реакция между веществами-реагентами, их взаимодействующие частицы должны столкнуться и, кроме этого, обладать достаточной энергией для преодоления некоторого энергетического барьера, мешающего им вступить во взаимодействие. Минимальная энергия, которой должны обладать молекулы (или другие частицы вещества), чтобы их столкновение привело к взаимодействию и образованию новых веществ, называется энергией активации.
Энергия активации представляет собой разность между высокой потенциальной энергией АК и низкой потенциальной энергией исходных веществ: Еа = ЕАК - Еисх.в-в (рис. 2).
Итак, осуществление реакции зависит от природы веществ-реагентов (в том числе их внутренней энергии), условий возникновения и протекания реакции и внешних факторов. Рассмотрим это на примере реакции железа с серой.
|
|
|



 Дайте определение понятия «химическая реакция».
Дайте определение понятия «химическая реакция».
 Мы живем в мире химических превращений веществ, протекающих в недрах и на поверхности Земли, в океане, в атмосфере и стратосфере. Множество реакций осуществляется в двигателях внутреннего сгорания, в топках, в производственных аппаратах, в клетках живых организмов, в окружающей нас живой и неживой природе. Одни реакции протекают чрезвычайно быстро (сгорание пороха, взаимодействие водорода и кислорода со взрывом в эвдиометре), другие реакции, наоборот, протекают медленно (взаимодействие оксида кремния (IV) и воды с горными породами). Многие из реакций человек может наблюдать непосредственно и контролировать их осуществление, но еще больше таких, ход которых проследить весьма сложно (реакции, протекающие в живых организмах, в живой и неживой природе). Неисчислимо многообразие химических реакций, как известных, так и еще неизученных, но по мере развития науки и методов научного исследования расширяются и углубляются знания о химических реакциях. Энергия активации представляет собой разность между высокой потенциальной энергией АК и низкой потенциальной энергией исходных веществ: Еа = Е чк - Еис% в в (рис. 2).
Итак, осуществление реакции зависит от природы веществ-реагентов (в том числе их внутренней энергии), условий возникновения и протекания реакции и внешних факторов. Рассмотрим это на примере реакции железа с серой.
Мы живем в мире химических превращений веществ, протекающих в недрах и на поверхности Земли, в океане, в атмосфере и стратосфере. Множество реакций осуществляется в двигателях внутреннего сгорания, в топках, в производственных аппаратах, в клетках живых организмов, в окружающей нас живой и неживой природе. Одни реакции протекают чрезвычайно быстро (сгорание пороха, взаимодействие водорода и кислорода со взрывом в эвдиометре), другие реакции, наоборот, протекают медленно (взаимодействие оксида кремния (IV) и воды с горными породами). Многие из реакций человек может наблюдать непосредственно и контролировать их осуществление, но еще больше таких, ход которых проследить весьма сложно (реакции, протекающие в живых организмах, в живой и неживой природе). Неисчислимо многообразие химических реакций, как известных, так и еще неизученных, но по мере развития науки и методов научного исследования расширяются и углубляются знания о химических реакциях. Энергия активации представляет собой разность между высокой потенциальной энергией АК и низкой потенциальной энергией исходных веществ: Еа = Е чк - Еис% в в (рис. 2).
Итак, осуществление реакции зависит от природы веществ-реагентов (в том числе их внутренней энергии), условий возникновения и протекания реакции и внешних факторов. Рассмотрим это на примере реакции железа с серой.