|
|
|
|
|
Глава 1. Химические реакции и закономерности их протекания Энергетика химических реакций
Из опыта следует, что условиями начала реакции послужили: а) измельчение и соприкосновение веществ-реагентов (железа и серы);
Итак, для возникновения реакции необходимо: 1. Столкновение молекул (или других частиц) веществ-реагентов, обладающих необходимым запасом энергии.
Характерной особенностью и признаком химических реакций является то, что они сопровождаются выделением или поглощением энергии. Энергия химических реакций называется химической энергией. Из курса физики вы знаете взаимопревращения разных видов энергии. Чаще всего химические реакции сопровождаются превращением химической энергии в тепловую энергию, и, наоборот, тепловая энергия и другие ее виды превращаются в химическую энергию. В 8 классе вы знакомились с классификацией реакций по энергетическому признаку (учебник химии для 8 класса, § 17).
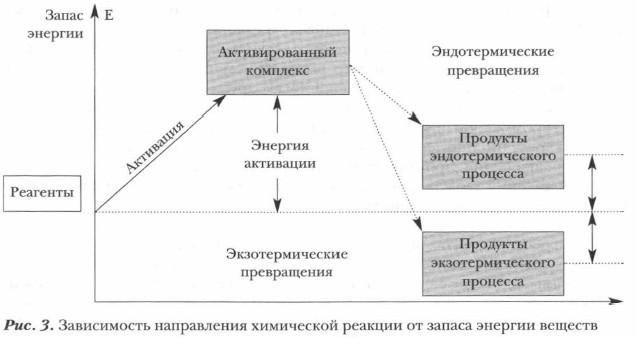
Следует иметь в виду, что одно и то же вещество может участвовать и в экзотермических, и в эндотермических процессах. Известно, что многие реакции в одних условиях протекают с выделением, в других — в обратном направлении, т. е. с поглощением энергии. Так, при 600 °С водород с кислородом реагируют со взрывом и с выделением большого количества теплоты, образуя воду. При 4000 °С, наоборот, водяные пары разлагаются на водород и кислород с поглощением энергии. Важнейшей характеристикой химической реакции является ее тепловой эффект. Напомним, что это то количество теплоты, которое выделяется или поглощается во время реакции. Протекание химических реакций связано с разрывом химических связей в веществах-реагентах и образованием новых химических связей в продуктах реакции. Итак, тепловой эффект реакции определяется разностью энергии образующихся связей и тех, которые претерпели разрыв. Он обозначается буквой Q и выражается в кДж/моль. Однако в некоторых книгах и учебниках теплота представлена в калориях и килокалориях (ккал). В современной медицинской и популярной литературе, касающейся питания, используются именно эти единицы теплоты и калорийности пищи. Для измерения количества энергии, высвобождаемой или поглощаемой в результате химической реакции, используются калориметры, представляющие теплоизолированные сосуды (с калориметрами вы знакомы из курса физики). Итак, тепловой эффект реакции равен разности между теплотой образования (энергией связи) продуктов реакции и исходных веществ. Чем больше тепла выделяется при образовании соединения, например MgO, полученного горением магния на воздухе, тем оно устойчивее, и, наоборот, соединения, при образовании которых энергия поглощается, малоустойчивы (NO и др.). Измерение и расчеты тепловых эффектов позволяют составить правильное представление об энергетической ценности реакции, возможном ее направлении и взаимоотношениях ее внутренних этапов. Уравнение реакции, в котором обозначен тепловой эффект, называется термохимическим уравнением. Задание. Запишите термохимические уравнения приведенных выше экзотермических и эндотермических реакций. Обобщим сведения о тепловом эффекте реакции, изучив схему (рис. 3).
Тепловой эффект реакции зависит только от состояния исходных веществ и конечных продуктов реакции, но не зависит от пути перехода реагентов в продукты, т. е. от промежуточных этапов реакции (закон Гесса). Основные понятия Энергия активации • Активированные комплексы • Тепловой эффект • Термохимические уравнения Вопросы и задания
|
|
|



 Демонстрационный опыт. Взаимодействие серы с железом. Приготовим смесь из 7 г железа и 4 г серы. Убедимся, что железо и сера сохраняют в смеси свои свойства (железо намагничивается, сера не тонет в воде). Нагреем часть смеси. Через некоторое время смесь загорается со вспышкой. Мы наблюдаем признаки реакции: выделение света и тепла. Образовалось новое вещество с новыми свойствами (оно не намагничивается магнитом и тонет в воде). Это вещество — сульфид железа FeS.
Демонстрационный опыт. Взаимодействие серы с железом. Приготовим смесь из 7 г железа и 4 г серы. Убедимся, что железо и сера сохраняют в смеси свои свойства (железо намагничивается, сера не тонет в воде). Нагреем часть смеси. Через некоторое время смесь загорается со вспышкой. Мы наблюдаем признаки реакции: выделение света и тепла. Образовалось новое вещество с новыми свойствами (оно не намагничивается магнитом и тонет в воде). Это вещество — сульфид железа FeS.
 Вспомните, какие реакции называются экзотермическими и эндотермическими. Приведите примеры таких реакций.
Вспомните, какие реакции называются экзотермическими и эндотермическими. Приведите примеры таких реакций.
 1. Что представляет собой внутренняя энергия вещества?
1. Что представляет собой внутренняя энергия вещества?
 3. Предложите возможные варианты изменения условий протекания реакций, влияющие на снижение энергетического барьера.
3. Предложите возможные варианты изменения условий протекания реакций, влияющие на снижение энергетического барьера.
 4. Рассчитайте тепловой эффект реакции горения аммиака в кислороде с образованием молекулярного азота и воды, зная энергии связей веществ, участвующих в реакциях: NH3 — 1161, O2 — 492, N2 — 942, Н2O — 919 кДж/моль.
4. Рассчитайте тепловой эффект реакции горения аммиака в кислороде с образованием молекулярного азота и воды, зная энергии связей веществ, участвующих в реакциях: NH3 — 1161, O2 — 492, N2 — 942, Н2O — 919 кДж/моль.