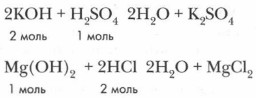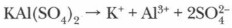|
|
|
|
|
Глава 2. Растворы. Теория электролитической диссоциации § 11. Соли как электролиты
Если рассматривать соли как продукт реакции нейтрализации, т. е. взаимодействия соответствующих основания и кислоты, то легко понять условия образования средних, кислых и осно́вных солей. Кислые и осно́вные соли — продукты неполного замещения в реакциях нейтрализации ионов водорода катионами металла или гидроксогрупп основания кислотными остатками. Они образуются двух- и многоосновными кислотами (Н2СО3, H2SO4, Н3РО4 и др.) или двух- и многокислотными основаниями (Mg(OH)2, Ba(OH)2, Cr(OH)3 и др.). Средние соли, в отличие от кислых и основных, являются продуктами полной нейтрализации:
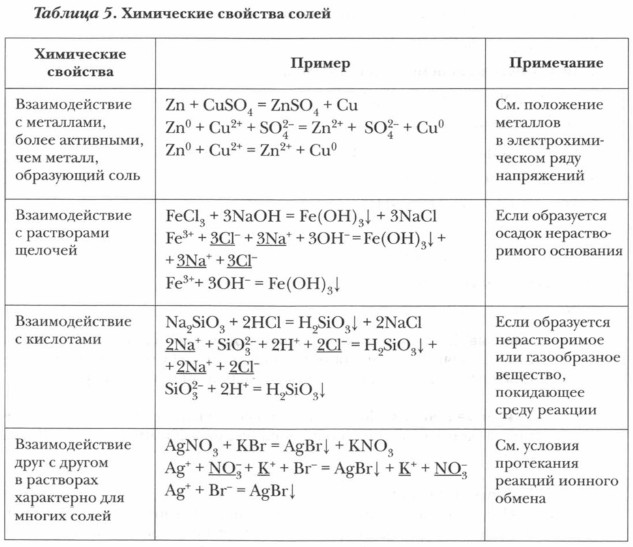
Химические свойства солейОбратимся к таблице 5. Задание. Составьте уравнения реакций в молекулярной, полной и сокращенной ионной форме, характеризующих химические свойства солей.
Задание. Составьте уравнения реакций в молекулярной, полной и сокращенной ионной форме, характеризующие химические свойства солей.
|
|
|



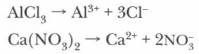
 Соли классифицируют по составу:
Соли классифицируют по составу: