|
|
|
|
|
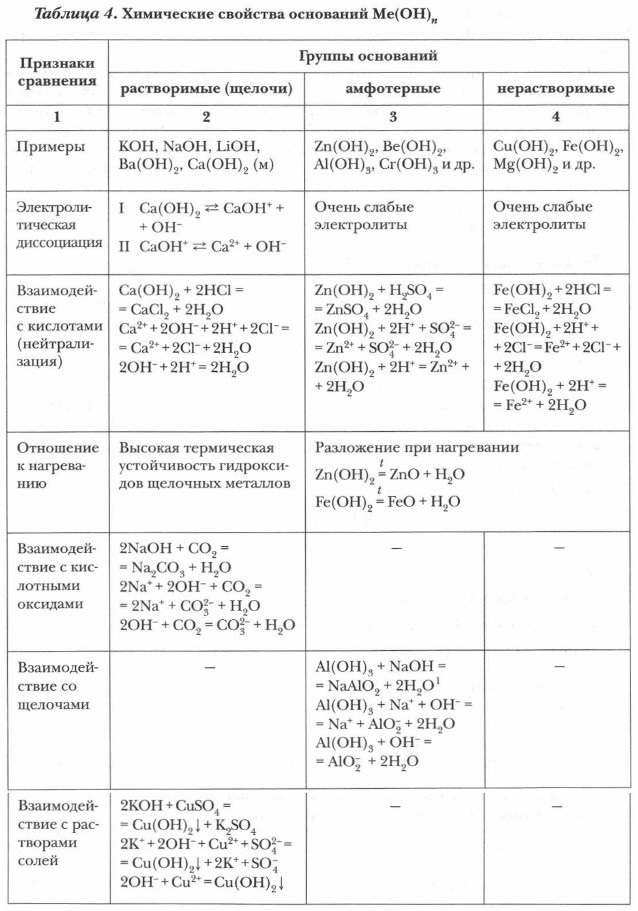
Глава 2. Растворы. Теория электролитической диссоциации Основания как электролитыЗадание. Приведите примеры уравнений реакций в молекулярной, полной и сокращенной ионной форме, характеризующих химические свойства растворимого, нерастворимого и амфотерного оснований.
1 В действительности в данной реакции в водной среде образуется сложное комплексное соединение Na3[Al(OH)6]. Получим нерастворимые основания и изучим их свойства.
1. В первую пробирку налейте 2 мл раствора сульфата меди CuSO4, а во вторую 2 мл раствора хлорида железа (III) FeCl3. 2. В каждую пробирку медленно добавьте раствор гидроксида натрия NaOH до появления признака реакции. 3. В каждую из пробирок добавьте растворы разбавленных кислот: в первую — серной H2SO4, во вторую — соляной НСl. 4. Отметьте наблюдения, укажите признаки реакций и составьте полные и сокращенные ионные уравнения. Основные понятия Гидроксид-ион • Кислотность оснований • Щелочи • Нерастворимые основания • Амфотерные гидроксиды Вопросы и задания
Са → Са(ОН)2 → СаСO3 → СаО → Са(ОН)2 → СаСl2
|
|
|



 Лабораторные опыты. Получение нерастворимых оснований и изучение их свойств.
Лабораторные опыты. Получение нерастворимых оснований и изучение их свойств.
 1. Дайте определения сильных и слабых электролитов. Назовите основания и кислоты — сильные электролиты.
1. Дайте определения сильных и слабых электролитов. Назовите основания и кислоты — сильные электролиты.
 2. Гидроксид алюминия — амфотерное малорастворимое в воде основание. С помощью уравнений реакций объясните, что происходит при его диссоциации.
2. Гидроксид алюминия — амфотерное малорастворимое в воде основание. С помощью уравнений реакций объясните, что происходит при его диссоциации.
 3. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
3. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: