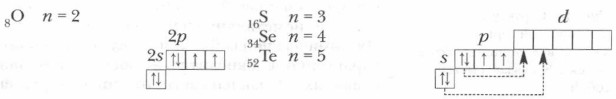|
|
|
|
|
Глава 4. Подгруппа кислорода и ее типичные представители § 15. Общая характеристика элементов подгруппы кислорода и их простых веществ
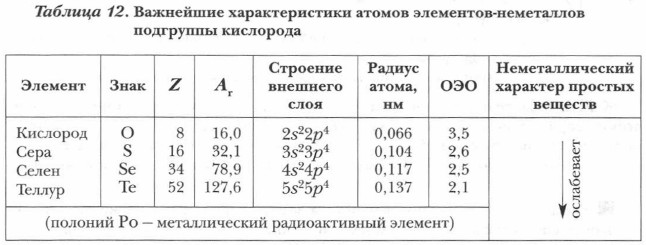
К VIA-группе периодической системы относятся элементы-неметаллы: кислород, сера, селен, теллур, а также металлический радиоактивный элемент — полоний. Элементы главной подгруппы VI группы принято называть халькогенами. Слово «халькогены» в переводе с греческого означает «руды рождающие».
У атомов элементов VIA-группы сходное строение внешнего электронного слоя, на котором находятся шесть валентных электронов — ns2np4. Этим определяется сходство их химических свойств. В соединениях с водородом и металлами они проявляют степень окисления -2 (H2Se, ZnS), а в соединениях с активными неметаллами — обычно +4 и +6 (SeO2, SO3 и др.). Для кислорода не типична положительная степень окисления, равная номеру группы, поскольку это элемент второго периода, у которого s- и p-орбитали заняты электронами, а d-подуровня у атомов элементов второго периода нет. Наиболее характерна для кислорода степень окисления -2
Все простые вещества, образованные атомами элементов VIA-группы, уступают в своей активности галогенам. Свойства этих элементов также находятся в периодической зависимости от порядкового номера Z и номера периода, в котором находится элемент. Неметалллические свойства наиболее ярко выражены у кислорода и серы, селен и теллур проявляют их в меньшей степени, а полоний уже металл (табл. 12).
С увеличением радиуса атома снижается окислительная активность и ослабевает неметаллический характер элементов в ряду: О → S → Se → Те. Физические и химические свойства простых веществ элементов VIA-группы
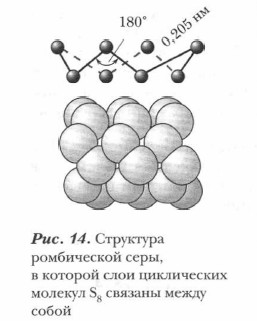
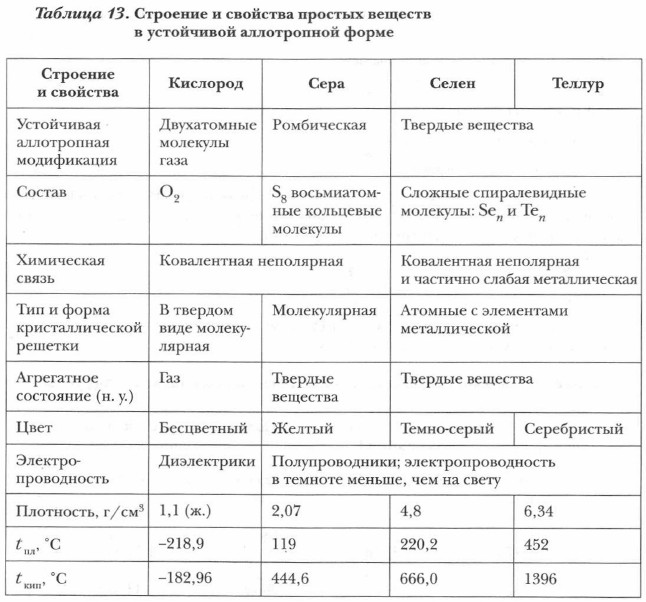
Физические и химические свойства халькогенов закономерно изменяются с увеличением порядкового номера элемента (Z). На их свойства влияет не только электронная структура атома и его радиус, но и тип кристаллической решетки вещества. Для халькогенов характерна аллотропия. Каждый из них имеет по нескольку аллотропных модификаций. Однако не все аллотропные модификации халькогенов устойчивы. Устойчивы при нормальных условиях (н. у.) у кислорода — газообразная форма, состоящая из двухатомных молекул O2; у серы — твердая ромбическая модификация с восьмиатомными циклическими молекулами S8 (рис. 14). У простых веществ элементов VIA-группы ярко, но в меньшей степени, чем у галогенов, выражены неметаллические свойства (табл. 13). Их химические свойства проявляются наиболее характерно в окислительно-восстановительных реакциях. В зависимости от другого реагента и условий протекания реакции они могут выступать в роли как окислителя, так и восстановителя.
|
|
|



 Что называют группой элементов? По каким признакам элементы объединяются в группу?
Что называют группой элементов? По каким признакам элементы объединяются в группу?
 Распространенность этих элементов в земной коре неравномерна. Как вы уже знаете, самым распространенным элементом на Земле является кислород. Сера — уже не столь распространенный элемент (0,03%), а селен и теллур относятся к рассеянным элементам (содержание селена в земной коре 5 • 10-6%, а теллура 5 • 10-7 %).
Распространенность этих элементов в земной коре неравномерна. Как вы уже знаете, самым распространенным элементом на Земле является кислород. Сера — уже не столь распространенный элемент (0,03%), а селен и теллур относятся к рассеянным элементам (содержание селена в земной коре 5 • 10-6%, а теллура 5 • 10-7 %).
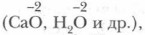 кроме соединения с фтором
кроме соединения с фтором 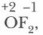 где степень окисления кислорода +2. Иная картина наблюдается у элементов третьего и последующих периодов VIA-группы. За счет d-орбитали их высшая положительная степень окисления равна номеру группы (+6).
где степень окисления кислорода +2. Иная картина наблюдается у элементов третьего и последующих периодов VIA-группы. За счет d-орбитали их высшая положительная степень окисления равна номеру группы (+6).