1. Горение сероводорода. Сероводород горит голубым пламенем в атмосфере кислорода или на воздухе при поджигании (см. рис. 20).
При недостатке кислорода реакция горения сероводорода идет иначе.
 Демонстрационный опыт. Неполное сгорание сероводорода. Прикроем пламя горящего сероводорода холодным предметом, например колбой с холодной водой, ограничивая этим доступ воздуха. На поверхности колбы появляется желтое пятно «сернистого цвета» — мелкие частицы серы. Следовательно, при недостатке кислорода идет неполное сгорание сероводорода:
Демонстрационный опыт. Неполное сгорание сероводорода. Прикроем пламя горящего сероводорода холодным предметом, например колбой с холодной водой, ограничивая этим доступ воздуха. На поверхности колбы появляется желтое пятно «сернистого цвета» — мелкие частицы серы. Следовательно, при недостатке кислорода идет неполное сгорание сероводорода:
Эта реакция имеет промышленное значение для производства серы из сероводорода.
2. Сероводород — сильный восстановитель. При взаимодействии с простыми и сложными веществами — окислителями (например, с галогенами и солями) сероводород проявляет свойства сильного восстановителя.
 Демонстрационный опыт. Восстановительные свойства сероводорода. В одну пробирку с небольшим количеством сероводородной воды прилейте бромную воду, в другую — иоднгую воду. Растворы обесцвечиваются. На поверхности растворов наблюдается появление серы:
Демонстрационный опыт. Восстановительные свойства сероводорода. В одну пробирку с небольшим количеством сероводородной воды прилейте бромную воду, в другую — иоднгую воду. Растворы обесцвечиваются. На поверхности растворов наблюдается появление серы:
3. Взаимодействие сероводорода с водой.
 Демонстрационный опыт. Растворение сероводорода в воде. К газоотводной трубке поднесите лакмусовую бумажку, смоченную водой, — лакмусовая бумажка краснеет: при растворении сероводорода в воде вещество диссоциирует с образованием Н3О+:
Демонстрационный опыт. Растворение сероводорода в воде. К газоотводной трубке поднесите лакмусовую бумажку, смоченную водой, — лакмусовая бумажка краснеет: при растворении сероводорода в воде вещество диссоциирует с образованием Н3О+:
Сероводородная кислота, диссоциирующая в воде ступенчато:
образует средние и кислые соли. Средние соли называют сульфидами (Na2S, CaS и др.), а кислые — гидросульфидами (NaHS). Например, эти соли получаются при взаимодействии с основаниями:
 Сульфиды щелочных и щелочноземельных металлов бесцветны. Многие сульфиды окрашены: сульфиды тяжелых металлов (d-элементов) PbS, CuS, NiS — черного цвета, CdS — желтого, ZnS — белого, MnS — розового. Большинство сульфидов нерастворимо. Однако сульфиды щелочных металлов хорошо растворимы в воде. На различной растворимости сульфидов и окраске многих из них основаны качественные и количественные реакции как на сульфид-ион, так и на некоторые катионы металлов.
Сульфиды щелочных и щелочноземельных металлов бесцветны. Многие сульфиды окрашены: сульфиды тяжелых металлов (d-элементов) PbS, CuS, NiS — черного цвета, CdS — желтого, ZnS — белого, MnS — розового. Большинство сульфидов нерастворимо. Однако сульфиды щелочных металлов хорошо растворимы в воде. На различной растворимости сульфидов и окраске многих из них основаны качественные и количественные реакции как на сульфид-ион, так и на некоторые катионы металлов.
Сероводородная кислота — слабый электролит, обладает общими свойствами кислот: изменяет окраску индикаторов, взаимодействует с растворами оснований и солей.
4. Сероводород участвует в обменных процессах с солями тяжелых металлов.
Качественная реакция на сероводородную кислоту и сульфиды — изменение окраски раствора и выпадение темного осадка сульфида меди CuS при добавлении раствора сульфата меди:
Сероводород и сульфиды в природе. В природе сероводород встречается в вулканических газах, в воде минеральных источников (например, источников Мацесты и Пятигорска на Кавказе). Он образуется при гниении растительных и животных организмов. Природные сульфиды составляют основу руд цветных и редких металлов, широко используются в металлургии для получения этих металлов.
Основные понятия
Сероводород • Сероводородная кислота • Сульфиды и гидросульфиды • Качественная реакция на сероводородную кислоту и сульфиды
Вопросы и задания
 1. Дайте общую характеристику строения молекулы сероводорода и его физических свойств.
1. Дайте общую характеристику строения молекулы сероводорода и его физических свойств.
 2. Сравните строение водородных соединений кислорода и серы.
2. Сравните строение водородных соединений кислорода и серы.
 3. Приведите примеры реакций, характеризующих сероводород как восстановитель.
3. Приведите примеры реакций, характеризующих сероводород как восстановитель.
 4. Перечислите свойства сероводородной кислоты. Чем объяснить ее способность образовывать соли разного состава: сульфиды и гидросульфиды? Запишите формулы этих солей.
4. Перечислите свойства сероводородной кислоты. Чем объяснить ее способность образовывать соли разного состава: сульфиды и гидросульфиды? Запишите формулы этих солей.
 5. Как можно распознать сероводородную кислоту и ее растворимые соли?
5. Как можно распознать сероводородную кислоту и ее растворимые соли?
 6. Какой объем сероводорода (при н. у.) потребуется для осаждения из раствора соли 119,5 г сульфида свинца?
6. Какой объем сероводорода (при н. у.) потребуется для осаждения из раствора соли 119,5 г сульфида свинца?
 7. Определите (в %) объемный состав смеси сероводорода и кислорода, если при ее сжигании было получено 200 мл сернистого газа SO2, а 40 мл кислорода не вступило в реакцию.
7. Определите (в %) объемный состав смеси сероводорода и кислорода, если при ее сжигании было получено 200 мл сернистого газа SO2, а 40 мл кислорода не вступило в реакцию.
 8. Почему для лечения больных используются сероводородные ванны, хотя сероводород токсичен для человека? Используя дополнительную литературу, объясните механизм воздействия сероводорода на организм человека.
8. Почему для лечения больных используются сероводородные ванны, хотя сероводород токсичен для человека? Используя дополнительную литературу, объясните механизм воздействия сероводорода на организм человека.
 9. Найдите ответы на вопросы, почему картины старых мастеров со временем темнеют и теряют первоначальную яркость и красоту, а также каким способом реставраторы обновляют эти картины.
9. Найдите ответы на вопросы, почему картины старых мастеров со временем темнеют и теряют первоначальную яркость и красоту, а также каким способом реставраторы обновляют эти картины.
<<< К началу параграфа



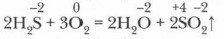
 Демонстрационный опыт. Неполное сгорание сероводорода. Прикроем пламя горящего сероводорода холодным предметом, например колбой с холодной водой, ограничивая этим доступ воздуха. На поверхности колбы появляется желтое пятно «сернистого цвета» — мелкие частицы серы. Следовательно, при недостатке кислорода идет неполное сгорание сероводорода:
Демонстрационный опыт. Неполное сгорание сероводорода. Прикроем пламя горящего сероводорода холодным предметом, например колбой с холодной водой, ограничивая этим доступ воздуха. На поверхности колбы появляется желтое пятно «сернистого цвета» — мелкие частицы серы. Следовательно, при недостатке кислорода идет неполное сгорание сероводорода:
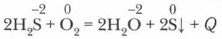
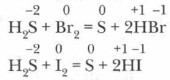
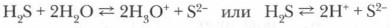
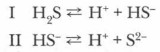

 Сульфиды щелочных и щелочноземельных металлов бесцветны. Многие сульфиды окрашены: сульфиды тяжелых металлов (d-элементов) PbS, CuS, NiS — черного цвета, CdS — желтого, ZnS — белого, MnS — розового. Большинство сульфидов нерастворимо. Однако сульфиды щелочных металлов хорошо растворимы в воде. На различной растворимости сульфидов и окраске многих из них основаны качественные и количественные реакции как на сульфид-ион, так и на некоторые катионы металлов.
Сульфиды щелочных и щелочноземельных металлов бесцветны. Многие сульфиды окрашены: сульфиды тяжелых металлов (d-элементов) PbS, CuS, NiS — черного цвета, CdS — желтого, ZnS — белого, MnS — розового. Большинство сульфидов нерастворимо. Однако сульфиды щелочных металлов хорошо растворимы в воде. На различной растворимости сульфидов и окраске многих из них основаны качественные и количественные реакции как на сульфид-ион, так и на некоторые катионы металлов.
 1. Дайте общую характеристику строения молекулы сероводорода и его физических свойств.
1. Дайте общую характеристику строения молекулы сероводорода и его физических свойств.
 2. Сравните строение водородных соединений кислорода и серы.
2. Сравните строение водородных соединений кислорода и серы.
 7. Определите (в %) объемный состав смеси сероводорода и кислорода, если при ее сжигании было получено 200 мл сернистого газа SO2, а 40 мл кислорода не вступило в реакцию.
7. Определите (в %) объемный состав смеси сероводорода и кислорода, если при ее сжигании было получено 200 мл сернистого газа SO2, а 40 мл кислорода не вступило в реакцию.
 8. Почему для лечения больных используются сероводородные ванны, хотя сероводород токсичен для человека? Используя дополнительную литературу, объясните механизм воздействия сероводорода на организм человека.
8. Почему для лечения больных используются сероводородные ванны, хотя сероводород токсичен для человека? Используя дополнительную литературу, объясните механизм воздействия сероводорода на организм человека.