|
|
|
|
|
Глава 4. Подгруппа кислорода и ее типичные представители § 18. Сероводород. Сульфиды
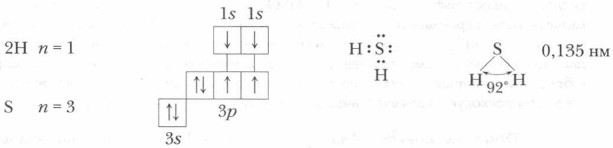
При изучении сероводорода мы будем исходить из взаимосвязи состава, строения и свойств этого вещества. Свойства же вещества определяют его получение и применение. Строение сероводорода. В составе сероводорода H2S два элемента-неметалла — водород и сера, атомы которых связаны ковалентными связями:
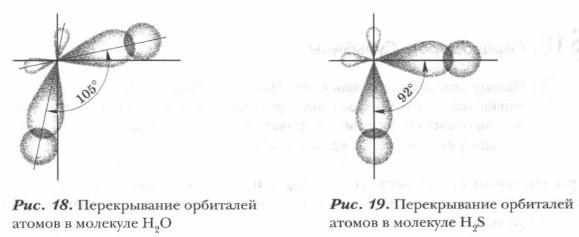
Молекула сероводорода по своему строению напоминает молекулу воды: она также имеет угловое строение и полярна (рис. 18, 19).
В молекуле сероводорода связи S—Н длиной 0,135 нм образуют валентный угол, близкий к прямому — 92°, а в молекуле воды он составляет около 105°. Проблема. Как объяснить различие в свойствах воды и сероводорода — близких по составу и строению веществ, образованных атомами элементов- аналогов? Ответ следует искать в различии строения их атомов, в характере связи, в различной полярности связей и молекул Н2O и H2S.
Физические свойства сероводорода. Сероводород при нормальных условиях представляет собой бесцветный газ, тяжелее воздуха, с неприятным запахом тухлых яиц, очень ядовит. Он имеет невысокую растворимость в воде по сравнению с НСl, поскольку его молекулы менее полярны, чем молекулы воды. При 20 °С в одном объеме воды растворяется 2,4 объема сероводорода (сравните: в одном объеме воды растворяется около 400 объемов хлороводорода). Водный раствор сероводорода называют сероводородной водой, которая проявляет свойства слабой кислоты и диссоциирует ступенчато. Отравляющее действие сероводорода объясняется его способностью взаимодействовать с гемоглобином крови. Из курса анатомии вам известно, что в состав гемоглобина крови входит железо, с которым сероводород соединяется.
Предельно допустимая концентрация сероводорода в воздухе лабораторий и промышленных предприятий считается 0,01 мг/л. Противоядием в случаях отравления сероводородом служит вдыхание чистого воздуха или кислорода с примесью небольшого количества хлора.
Для того чтобы экспериментально изучить химические свойства сероводорода, его надо сначала получить. Получение сероводорода в лаборатории. Со способом получения сероводорода взаимодействием серы с водородом вы уже познакомились при изучении свойств серы:
Обычно в лаборатории сероводород получают взаимодействием твердого сульфида железа с раствором кислоты: H2SO4 (1:5) или НСl (1:2): FeS + 2НСl = FeCl2 + H2S↑
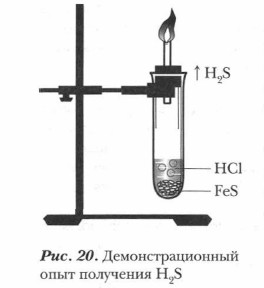
Получение сероводорода (рис. 20). В пробирку положим 5-6 кусочков сульфида железа величиной с горошину. Наполовину заполним пробирку раствором соляной кислоты и закроем пробкой с газоотводной трубкой. Если реакция вначале пойдет медленно, то слегка подогреем пробирку. (Опыт выполняется под тягой, так как сероводород очень ядовит.) Наблюдаем появление пузырьков газа. Подожжем выделяющийся из газоотводной трубки газ. Он горит голубым пламенем. Это сероводород.
|
|
|



 Почему водородное соединение серы имеет форму H2R?
Почему водородное соединение серы имеет форму H2R?
 Вы уже знаете, что чем больше разница между значениями ОЭО взаимодействующих атомов, тем более полярна их связь. Так, в связи Н—О в молекуле воды эта разность ОЭО водорода и кислорода составляет 3,5 -2,1= 1,4; в связи Н—S в молекуле сероводорода разность значений ОЭО водорода и серы составляет 2,5 - 2,1 = 0,4. Это свидетельствует о том, что степень полярности связей Н—S намного ниже, чем Н—О. Полярность молекулы сероводорода также меньше, чем полярность молекулы воды.
Вы уже знаете, что чем больше разница между значениями ОЭО взаимодействующих атомов, тем более полярна их связь. Так, в связи Н—О в молекуле воды эта разность ОЭО водорода и кислорода составляет 3,5 -2,1= 1,4; в связи Н—S в молекуле сероводорода разность значений ОЭО водорода и серы составляет 2,5 - 2,1 = 0,4. Это свидетельствует о том, что степень полярности связей Н—S намного ниже, чем Н—О. Полярность молекулы сероводорода также меньше, чем полярность молекулы воды.
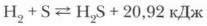
 Демонстрационный опыт.
Демонстрационный опыт.