|
|
|
|
|
Глава 4. Подгруппа кислорода и ее типичные представители Кислородсодержащие соединения серыСоли сернистой кислоты. Для сернистой кислоты как для двухосно́вной кислоты характерны два вида солей: средние, называемые сульфитами (Na2SO3, MgSO3), и кислые, называемые гидросульфитами (NaHSO3 и др.). Средние соли (за исключением сульфитов аммония и щелочных металлов) нерастворимы в воде, но все они разлагаются кислотами. Качественная реакция на сернистую кислоту и ее соли. Реактивом на сернистую кислоту и ее соли, а точнее на сульфит-ион Na2SO3 + 2НСl = 2NaCl + SO2↑ + Н2O Применение кислородсодержащих соединений серы (IV). Оксид серы (IV) — превосходное дезинфицирующее и отбеливающее средство. Он применяется для окуривания складов с целью уничтожения паразитов и микробов, для уничтожения плесени в бродильных чанах и винных бочках, а также для консервирования плодов и фруктов. Этот процесс называется сульфитизацией. Как мягкий отбеливатель его широко используют для отбеливания бумаги, соломы, кукурузной муки, а в текстильной промышленности для отбеливания шерсти и шелка. Соли сернистой кислоты также используют как отбеливатели: сульфит натрия — в текстильной, а гидросульфит натрия — в бумажной промышленности. Сульфит и гидросульфит натрия широко применяют в фотографии. В промышленности диоксид серы получают сжиганием серы на воздухе, обжигом богатого серой минерала — пирита FeS2, а также улавливанием его из печных газов, образующихся при выплавке ряда металлов из сернистых руд. В лаборатории диоксид серы получают действием H2SO4 на сульфит натрия. Основные понятия Оксид серы (IV) • Сернистая кислота • Сульфиты и гидросульфиты • Качественная реакция на сернистую кислоту и ее соли Вопросы и задания
S — H2S → S → SO2 → Na2O3 → SO2 → SO3?
|
|
|



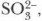 является ион гидроксония (Н3O+ или Н+), т. е. любая сильная кислота, при добавлении которой молекулы сернистой кислоты разлагаются с образованием сернистого газа, что распознается по характерному запаху:
является ион гидроксония (Н3O+ или Н+), т. е. любая сильная кислота, при добавлении которой молекулы сернистой кислоты разлагаются с образованием сернистого газа, что распознается по характерному запаху:
 1. Вычислите относительную плотность оксида серы (IV) по водороду, воздуху и кислороду.
1. Вычислите относительную плотность оксида серы (IV) по водороду, воздуху и кислороду.
 2. Дайте краткую характеристику сернистому ангидриду и сернистой кислоте. Какие группы их общих свойств и реакций можно выделить?
2. Дайте краткую характеристику сернистому ангидриду и сернистой кислоте. Какие группы их общих свойств и реакций можно выделить?
 3. Дайте сравнительную характеристику сероводородной и сернистой кислот. Что общего и какие различия в свойствах они имеют?
3. Дайте сравнительную характеристику сероводородной и сернистой кислот. Что общего и какие различия в свойствах они имеют?