|
|
|
|
|
Глава 4. Подгруппа кислорода и ее типичные представители § 20. Кислородсодержащие соединения серы (VI)К кислородсодержащим соединениям серы (VI) относятся их высшие формы — оксид серы (VI) SO3 и соответствующая ему серная кислота H2SO4.
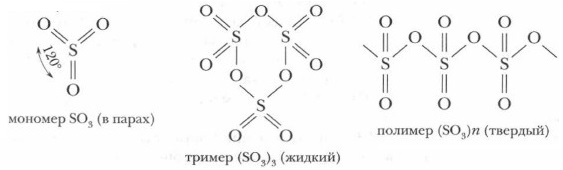
Оксид серы (VI) SO3Состав и строение. Оксид серы(VI) называют также серным ангидридом или триоксидом серы. Отдельные молекулы его (в газообразном состоянии) имеют форму равностороннего треугольника, в центре которого — предельно окисленный атом серы, а в вершинах — атомы кислорода. Все четыре атома, составляющие молекулу SO3, расположены в одной плоскости, а валентные углы между ними равны 120°. Молекулы оксида серы (VI) склонны к полимеризации, т. е. к последовательному соединению друг с другом в более крупные молекулы.
Физические свойства. Оксид серы (VI) — бесцветная маслянистая жидкость, кипящая при 44,7 °С и кристаллизующаяся при 17 °С. При хранении, особенно в присутствии влаги, он полимеризуется и превращается в твердое прозрачное вещество (полимер), напоминающее лед и состоящее из длинных шелковистых кристаллов. Оксид серы (VI) малорастворим в воде, но хорошо растворяется в серной кислоте. Химические свойства. SO3 — кислотный оксид. Растворяясь, он реагирует с водой, образуя серную кислоту. Это реакция экзотермическая и сопровождается выделением большого количества теплоты: Н2O + SO3 = H2SO4 + 90 кДж
Получение. Оксид серы (VI) можно получить каталитическим окислением оксида серы (IV):
Реакция окисления оксида серы (IV) является обратимой. Она имеет огромное значение для промышленного получения серной кислоты. При изучении химии вы познакомились с реакциями, идущими до конца, на примере реакций ионного обмена электролитов узнали, в каких случаях это происходит, т. е. познакомились с условиями необратимости реакций. Серная кислота H2SO4
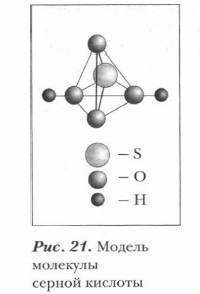
Серная кислота — молекулярное вещество, относящееся к сильным двухосновным кислотам. Структуру молекулы серной кислоты изображает ее модель, приведенная на рисунке 21. Физические свойства. Безводная серная кислота — тяжелая бесцветная маслянистая жидкость, растворяющаяся в воде в любых соотношениях. Она гигроскопична, нелетуча, без запаха, не проводит электрический ток. При 10,3 °С она затвердевает, образуя кристаллы, похожие на лед. Серная кислота кипит при 296 °С с разложением. Серная кислота, поступающая в продажу, имеет плотность 1,84 г/см3 (массовая доля серной кислоты около 96 %). Серная кислота очень хорошо растворима в воде: она растворяется в ней в любых пропорциях.
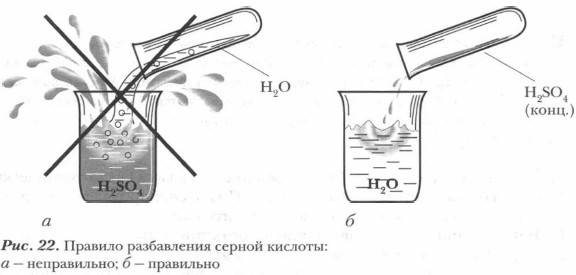
При растворении серной кислоты в воде образуются гидраты и выделяется большое количество теплоты. Поэтому смешивать концентрированную серную кислоту с водой надо крайне осторожно, соблюдая следующее правило безопасности:
Если, наоборот, вливать воду в кислоту, вода не будет опускаться вниз, а будет проникать лишь на небольшую глубину. Разогревание раствора вследствие идущей там реакции гидратации сосредоточится на поверхности. Раствор здесь может нагреться до кипения. Образующийся пар будет разбрызгивать кислоту (учитывая, что кислота имеет в 3 раза меньшую теплоемкость, чем вода). Серная кислота — химически активное вещество. Однако следует иметь в виду, что свойства разбавленной и концентрированной серной кислоты весьма различны.
Химические свойства разбавленной серной кислоты. В растворе серная кислота, будучи сильным электролитом, изменяет окраску индикаторов: лакмус становится красным, а метиловый оранжевый розовеет. Она ступенчато диссоциирует на ионы:
Проблема. Почему степень диссоциации по первой ступени намного выше, чем по второй? Как двухосновная кислота серная кислота образует соли двух видов: средние — сульфаты (Na2SO4, CaSO4) и кислые — гидросульфаты (NaHSO4, Ca(HSO4)2 и др.)?
Серная кислота в растворе обладает общими для класса кислот химическими свойствами, которые обусловлены ионом Н+ (Н3O+). Они проявляются в реакциях ионного обмена и окислительно-восстановительных. 1. Окислительно-восстановительные реакции характерны для взаимодействия растворов серной кислоты с металлами. Металлы, стоящие в ряду активности (в ряду напряжения) до водорода (за исключением свинца), окисляются ионом водорода кислоты, а сам он восстанавливается до молекулярного водорода. Zn + H2SO4 = ZnSO4 + H2↑
Металлы, стоящие в ряду активности после водорода, с разбавленной серной кислотой не взаимодействуют (Сu, Ag, Pt, Аu). 2. Реакции обмена происходят при взаимодействии серной кислоты с основными и амфотерными оксидами, основаниями и солями. Задание. Запишите молекулярные, полные и сокращенные ионные уравнения таких реакций. Качественная реакция на серную кислоту и ее соли, с помощью которой можно распознать их среди других веществ, — реакция с растворимыми солями бария: H2SO4 + ВаСl2 = BaSO4↓ + 2НСl
Суть процесса: выпадает белый осадок сульфата бария, нерастворимый ни в воде, ни в кислотах:
Катион бария Ва2+ является реагентом на сульфат-ион
Опыт 1. Качественная реакция на сульфат-ион. Налейте в одну пробирку 1 мл раствора разбавленной серной кислоты, а в другую 1 мл раствора сульфата натрия. Прилейте в обе пробирки такой же объем раствора хлорида бария. Что наблюдаете? Во вторую пробирку добавьте немного раствора азотной кислоты. Что изменилось? Запишите уравнения реакций в полной и сокращенной ионной форме. Опыт 2. Экспериментальная задача. В трех пробирках без этикеток находятся растворы серной кислоты, сульфата натрия и сульфита натрия. С помощью каких реактивов и в какой последовательности следует распознавать эти вещества? Составьте план исследования. Проделайте эти реакции. Запишите уравнения химических реакций.
|
|
|



 Приведите примеры известных вам способов получения серного ангидрида и серной кислоты. Напишите уравнения соответствующих реакций.
Приведите примеры известных вам способов получения серного ангидрида и серной кислоты. Напишите уравнения соответствующих реакций.
 Безводный ангидрид серной кислоты является довольно сильным окислителем: при соприкосновении с ним фосфор воспламеняется; при взаимодействии его с иодидом (или бромидом) калия выделяется свободный иод (бром). При этом триоксид восстанавливается до диоксида серы.
Безводный ангидрид серной кислоты является довольно сильным окислителем: при соприкосновении с ним фосфор воспламеняется; при взаимодействии его с иодидом (или бромидом) калия выделяется свободный иод (бром). При этом триоксид восстанавливается до диоксида серы.
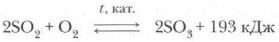
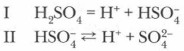
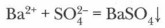
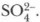
 Лабораторные опыты
Лабораторные опыты