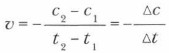|
|
|
|
|
Глава 1. Химические реакции и закономерности их протекания § 2. Скорость химической реакцииВ процессе обучения химии вы неоднократно наблюдали, что реакции протекают неодинаково: одни — быстро, другие — медленно, т. е. идут с разной скоростью.
Понятие «скорость» вам хорошо известно из курса физики. Скорость показывает изменения какой-либо величины во времени. Действительно, разные реакции протекают по-разному. Многие реакции протекают очень быстро, например реакции обмена между растворами кислот и оснований или некоторых солей друг с другом. Мгновенно происходят реакции, которые сопровождаются взрывом, например взаимодействие водорода с фтором. Некоторые же реакции осуществляются в течение более длительного времени, иногда нескольких часов или лет. Примером таких реакций служат превращения, происходящие в горных породах под воздействием атмосферных явлений (дождя, ветра и др.). С разной скоростью протекают и биохимические процессы в организмах.
Подумаем вместе: в реакцию вступают разные вещества и в разном состоянии: твердом, жидком, газообразном. Обратимся к известным вам реакциям обмена, протекающим в растворе, например к реакции нейтрализации: 2NaOH + H2SO4 = Na2SO4 + 2Н2О Очевидно, что по мере протекания химической реакции исходные вещества (гидроксид натрия и серная кислота) расходуются, следовательно, с течением времени будет уменьшаться их концентрация, а концентрация образующихся веществ (сульфата натрия и воды) будет увеличиваться. Это обусловлено тем, что в начале реакции концентрация реагентов наибольшая, а следовательно, наибольшая вероятность и соударений частиц реагирующих веществ. По мере того как исходные вещества превращаются в продукты реакции, концентрация этих веществ уменьшается. Вместе с этим уменьшается и вероятность столкновения молекул (или других частиц, например ионов).
Если при постоянной температуре и объеме концентрация одного из реагирующих веществ уменьшилась от с1 до с2 за промежуток времени от t1 до t2, то в соответствии с определением скорость реакции за этот промежуток времени равна:
Для реакций, протекающих в растворах, концентрации реагентов выражаются в молях на 1 л (моль/л), а скорость реакции в молях на 1 л за 1 с (моль/л • с). Скорость химических реакций зависит от многих факторов. Важнейшие из них: 1) природа реагирующих веществ и степень их измельчения (для твердых веществ);
На реакции газообразных веществ оказывает влияние давление, так как с изменением давления изменяется их концентрация. Чем выше давление, тем меньше объем смеси газов, а следовательно, больше концентрация веществ в этом уменьшенном объеме. Рассмотрим влияние указанных выше факторов на скорость химической реакции.
Реакционная способность веществ характеризуется их природой. Но о реакционной способности веществ — участников реакции судят по величине скорости ее протекания. Чем больше концентрация вступающих в реакцию веществ, тем чаще столкновение их молекул или других частиц во время их неупорядоченного движения в растворе или газах. Степень измельчения реагентов также влияет на скорость реакции. Твердые вещества быстрее реагируют в мелкораздробленном состоянии, и реакции с их участием протекают быстрее. Температура также оказывает влияние на скорость химических реакций: с ее повышением скорость реакции, как правило, возрастает, так как возрастает скорость движения частиц. Экспериментально доказано, что при повышении температуры на 10 °С скорость увеличивается в 2-4 раза (если принять, что при О °С скорость реакции = 1). Однако при дальнейшем повышении температуры скорость реакции резко возрастает, например при увеличении температуры до 30 °С скорость некой реакции увеличивается в 8 раз, а при 100 °С скорость реакции увеличивается более чем в тысячу раз. Этим объясняется роль нагревания веществ для начала и ускорения хода реакции. Вы неоднократно убеждались в этом при наблюдении или самостоятельном проведении опытов (подогревание смеси серы с железом приводит к их бурной реакции, нагревание пробирки с цинком и с раствором соляной кислоты значительно ускоряет их реакцию и др.). Убедимся во влиянии перечисленных факторов на скорость реакции, проделав лабораторные опыты. Опыт 1. В две пробирки нальем (не более 1/2) раствор НС1 (1 :2). Осторожно опустим в них по кусочку металлов разной природы: цинка и магния. Что наблюдаете? Опыт 2. В две пробирки, наклонив их, опустим по кусочку одного и того же металла — цинка — и осторожно прильем растворы серной кислоты: в первую пробирку H2SO4 1 :5, а во вторую — 1 : 10. В какой из них реакция идет быстрее? Опыт 3. В две пробирки с одинаковыми растворами соляной кислоты (1:2) добавим: в первую пробирку — гранулу цинка, а во вторую пробирку осторожно поместим цинковую пыль. Что наблюдаете? Опыт 4. В две пробирки с одинаковым раствором серной кислоты (1 :10) добавим по грануле цинка. Одну из пробирок нагреем. Различается ли их скорость реакции? При изучении способов получения кислорода в лаборатории в 8 классе вы уже познакомились с катализаторами.
|
|
|



 Приведите примеры реакций, протекающих с разной скоростью.
Приведите примеры реакций, протекающих с разной скоростью.
 Скорость химических реакций — один из решающих параметров протекания химических процессов, осуществляемых в промышленности, в научно-производственной деятельности, так как он определяет производительность и эффективность производства. Даже в том случае, если химизм переработки сырья прост, но время, затраченное на получение продукта значительно, такой процесс не рентабелен. Как определить скорость химической реакции?
Скорость химических реакций — один из решающих параметров протекания химических процессов, осуществляемых в промышленности, в научно-производственной деятельности, так как он определяет производительность и эффективность производства. Даже в том случае, если химизм переработки сырья прост, но время, затраченное на получение продукта значительно, такой процесс не рентабелен. Как определить скорость химической реакции?