|
|
|
|
|
Глава 4. Подгруппа кислорода и ее типичные представители Кислородсодержащие соединения серы (VI)Химические свойства концентрированной серной кислоты. Выделяют две особенности этой кислоты:
При проведении опытов с концентрированными кислотами (серной, азотной, хлороводородной, фосфорной и др.) надо строго соблюдать правила техники безопасности: 1. Проводить опыты в вытяжном шкафу химического кабинета.
1. Концентрированная серная кислота — сильный окислитель. Она окисляет простые вещества (неметаллы, металлы) и сложные. а) Окисление неметаллов. Уголь и сера окисляются серной кислотой до их диоксидов:
б) Окисление сложных веществ:
в) Взаимодействие концентрированной серной кислоты с металлами. В отличие от разбавленной серной кислоты концентрированная кислота окисляет почти все металлы, стоящие в ряду активности до водорода, за исключением алюминия, железа, хрома и никеля, которые под ее воздействием покрываются твердой нерастворимой оксидной пленкой (это свойство используется для хранения и перевозки безводной серной кислоты в стальных баллонах). Взаимодействуя с активными металлами (Na, К, Са), сера восстанавливается до атомов в степени окисления -2. С металлами средней активности сера восстанавливается до атомов в степени окисления +4 и 0. Концентрированная серная кислота реагирует и с малоактивными металлами, стоящими в ряду активности после водорода (медь, серебро, ртуть). С платиной и золотом она не реагирует. Реакции идут при нагревании. Убедимся в реальности протекания одной из таких реакций и ее условий.
1. В демонстрационную пробирку положим несколько кусочков медной стружки или медной проволоки и прильем концентрированной серной кислоты. Изменений не наблюдается. 2. На край пробирки поместим влажную лакмусовую бумажку. Пробирку осторожно нагреем. Выделяется сернистый газ (его определяют по запаху или покраснению смоченной водой лакмусовой бумажки), раствор в пробирке приобретает голубую окраску, образуется сульфат меди, идет окислительно-восстановительная реакция окисления меди кислотой.
Этот процесс включает в себя две реакции: окислительно-восстановительную и обменную реакцию солеобразования, идущую без изменения степеней окисления. 2. Концентрированная серная кислота активно взаимодействует с водой, образуя гидраты: H2SO4 + nН2O = H2SO4 • nН2O + Q Это свойство широко используется в лаборатории и промышленности для осушки газов и для обезвоживания некоторых веществ. Серная кислота настолько жадно присоединяет к себе воду, что даже способна отнимать от веществ элементы, входящие в состав воды (водород и кислород), например из органических веществ, состоящих из элементов углерода, водорода и кислорода, — сахара, клетчатки, крахмала и др. Убедимся в этом на опытах.
1. Обугливание лучины и бумаги, а) Опустим лучину в концентрированную серную кислоту. Она почернела. Ополоснем ее в воде. Рассмотрим лучину: на ее поверхности образовался уголь — она обуглилась. б) Положим лист белой бумаги на кафельную плитку. Лучину опустим в раствор серной кислоты (1:5) и затем напишем на листе бумаги формулу серной кислоты. Осторожно нагреем лист над пламенем спиртовки. Кислота становится более концентрированной и обугливает бумагу, на которой отчетливо проявляется надпись: H2SO4. 2. Обугливание сахара. В небольшой химический стакан поместим около 10 г растертого в порошок сахара (сахарной пудры). К нем)7 по стеклянной палочке осторожно прильем около 5 мл концентрированной серной кислоты и быстро перемешаем до образования густой кашицы, оставив палочку посередине стакана. Происходит реакция, сахар обугливается (при этом уголь частично превращается в углекислый газ за счет восстановления серной кислоты до сернистого газа). Выделяющиеся газы (СO2, SO2) вспучивают остальную массу углерода, которая выходит из стаканчика (рис. 23). С помощью стеклянной палочки эту пористую углеродную массу можно вынуть в виде «эскимо»: С12Н22O11 + H2SO4 → 12С + H2SO4 • 11Н2O Промышленное значение и применение серной кислоты. Серная кислота — важнейший продукт химической промышленности. В промышленно развитых странах производство серной кислоты занимает первое место среди других химических производств. По производству и использованию серной кислоты судят о развитии промышленности в целом и о химической промышленности в частности. Серная кислота применяется практически во всех областях народного хозяйства и относится к стратегическим видам продуктов производства. Широкое применение находят и соли серной кислоты. Сульфаты аммония и калия используются в качестве удобрений; сульфат натрия — в медицине (в качестве слабительного средства), в производстве соды и стекла. Сульфат кальция (в виде кристаллогидратов: гипса, алебастра и др.) широко применяется в строительном деле и в медицине; купоросы (железный и медный) применяют для борьбы с вредителями растений при опрыскивании, сульфат цинка — для производства минеральных красок и в медицине. Сложно перечислить все области применения серной кислоты и ее солей. Незаменимы они и в химических лабораториях для научных исследований и обучения. Основные понятия Оксид серы (VI) • Свойства серной кислоты • Качественная реакция на сульфат-ион Вопросы и задания
|
|
|



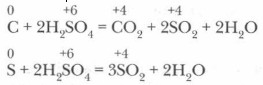
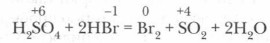
 Демонстрационный опыт. Реакция концентрированной серной кислоты с медью.
Демонстрационный опыт. Реакция концентрированной серной кислоты с медью.
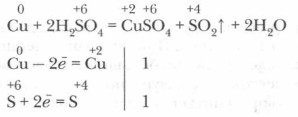
 Серную кислоту расходуют в огромных количествах (более 50 % всей получаемой кислоты) для производства минеральных удобрений (суперфосфата, сульфата аммония и др.). Ее используют для получения других кислот (соляной, уксусной, плавиковой, фосфорной и др.) из их солей. Много серной кислоты идет на очистку нефтепродуктов от вредных примесей. Серная кислота необходима при производстве взрывчатых веществ, пластмасс, искусственных волокон, красителей. Ее применяют в машиностроении для очистки поверхности металлов перед их электродным покрытием другими металлами (никелирование, хромирование, цинкование). Серную кислоту используют в аккумуляторах, применяемых в транспортных средствах.
Серную кислоту расходуют в огромных количествах (более 50 % всей получаемой кислоты) для производства минеральных удобрений (суперфосфата, сульфата аммония и др.). Ее используют для получения других кислот (соляной, уксусной, плавиковой, фосфорной и др.) из их солей. Много серной кислоты идет на очистку нефтепродуктов от вредных примесей. Серная кислота необходима при производстве взрывчатых веществ, пластмасс, искусственных волокон, красителей. Ее применяют в машиностроении для очистки поверхности металлов перед их электродным покрытием другими металлами (никелирование, хромирование, цинкование). Серную кислоту используют в аккумуляторах, применяемых в транспортных средствах.
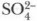 • Сульфаты • Серная кислота
• Сульфаты • Серная кислота
 1. Дайте характеристику строения и свойств оксида серы (VI).
1. Дайте характеристику строения и свойств оксида серы (VI).
 3. Опишите физические свойства и окислительные способности концентрированной серной кислоты. Дайте им научное обоснование. Составьте уравнения реакций концентрированной серной кислоты с магнием и ртутью и схемы их электронного баланса. Почему в этих реакциях образуются разные продукты?
3. Опишите физические свойства и окислительные способности концентрированной серной кислоты. Дайте им научное обоснование. Составьте уравнения реакций концентрированной серной кислоты с магнием и ртутью и схемы их электронного баланса. Почему в этих реакциях образуются разные продукты?
 5. Чему равен объем (л), который занимает 8,0 г оксида серы(IV) при н. у.: 1) 2,8; 2) 5,6; 3) 11,2; 4) 22,4?
5. Чему равен объем (л), который занимает 8,0 г оксида серы(IV) при н. у.: 1) 2,8; 2) 5,6; 3) 11,2; 4) 22,4?
 6. В газовой смеси, состоящей из оксида серы (IV) и кислорода с относительной плотностью смеси по водороду (dH2), равной 24, часть оксида серы (IV) прореагировала и образовалась газовая смесь с dH2 на 25% больше, чем плотность исходной смеси. Рассчитайте состав равновесной смеси в объемных процентах.
6. В газовой смеси, состоящей из оксида серы (IV) и кислорода с относительной плотностью смеси по водороду (dH2), равной 24, часть оксида серы (IV) прореагировала и образовалась газовая смесь с dH2 на 25% больше, чем плотность исходной смеси. Рассчитайте состав равновесной смеси в объемных процентах.