|
|
|
|
|
Глава 5. Подгруппа азота и ее типичные представители Аммиак2. Реакции присоединения. Аммиак активно соединяется как с водой, так и с кислотами.
При взаимодействии аммиака с соляной кислотой происходит реакция присоединения:
Аммиак взаимодействует и с другими кислотами. Продуктами взаимодействия аммиака с кислотами являются соли аммония. Проблема. За счет чего аммиак может вступать в реакции присоединения, если все валентные электроны использованы на образование связи, а атомы азота и водорода в его молекуле имеют устойчивые электронные конфигурации?
Откуда они взялись в растворе? По всей вероятности, вследствие отнятия от молекул воды ионов водорода Н+ молекулами аммиака. Вспомните механизм образования иона гидроксония при растворении хлороводорода в воде (см. § 5). За счет неподеленной пары электронов атома азота молекулы аммиака устанавливают прочную ковалентную связь с ионом водорода молекулы воды по донорно-акцепторному механизму с образованием катиона аммония В водном растворе ион аммония играет роль катиона, а гидроксид-ион воды создает щелочную среду.
Задание. Напишите уравнения реакций аммиака с азотной и серной кислотами. Назовите продукты этих реакций. Соли аммония. С многоосновными кислотами аммиак образует соли двух видов: кислые, например NH4HSO4 (гидросульфат аммония), и средние, например (NH4)2SO4 (сульфат аммония). Свойства солей аммония сходны со свойствами солей щелочных металлов, особенно солей калия и рубидия. Это белые кристаллические вещества, хорошо растворимые в воде (см. таблицу растворимости). Они сильные электролиты. Твердые соли термически неустойчивы и при нагревании разлагаются. Если соль аммония образована летучей кислотой, то при нагревании выделяются кислота и аммиак, способные при охлаждении вновь образовать соль:
В остальном соли аммония проявляют общие свойства класса солей. Качественной реакцией для иона аммония
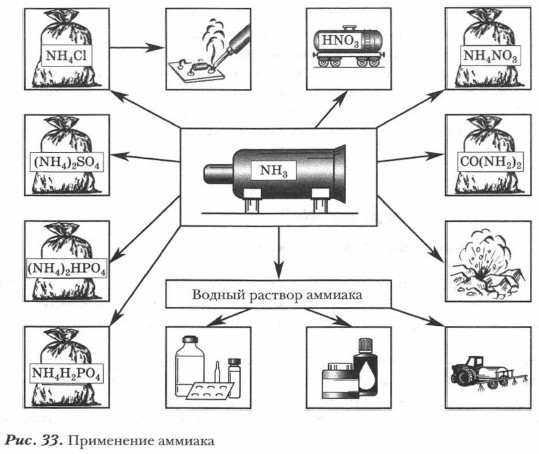
Применение аммиака и солей аммония. Большая часть аммиака используется для производства азотной кислоты и ее солей, соды, минеральных удобрений, содержащих азот. Жидкий аммиак применяют в холодильных установках. Нашатырный спирт применяют в медицине, а также в быту для выведения пятен в составе пятновыводящих смесей. Водные растворы аммиака применяют в химических лабораториях (рис. 33).
Широкое практическое применение находят и соли аммония. Нитрат аммония в смеси с сульфатом аммония используется как азотсодержащее удобрение. Нитрат аммония является компонентом при производстве взрывчатых веществ — аммоналов. Хлорид аммония (нашатырь1) применяют при пайке металлов для очистки их поверхности (за счет хлороводорода, выделяющегося при разложении нашатыря), при их сварке, а кроме того — в сухих элементах (электрических батареях) в качестве электролита. 1 Нашатырь — техническое название хлорида аммония. Не путайте с нашатырным спиртом. Основные понятия Способы получения аммиака • Свойства аммиака • Соли аммония • Катион аммония и механизм его образования • Качественная реакция на ион аммония Вопросы и задания
Напишите уравнения этих реакций и укажите их условия.
|
|
|



 Демонстрационный опыт. Взаимодействие раствора аммиака с соляной кислотой. Смочим в концентрированных растворах соляной кислоты и аммиака две чистые стеклянные палочки и сблизим их. Выделяется белое облако дыма хлорида аммония.
Демонстрационный опыт. Взаимодействие раствора аммиака с соляной кислотой. Смочим в концентрированных растворах соляной кислоты и аммиака две чистые стеклянные палочки и сблизим их. Выделяется белое облако дыма хлорида аммония.
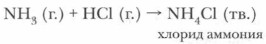
 Обратимся вновь к строению атома азота и молекулы аммиака.
Обратимся вновь к строению атома азота и молекулы аммиака.

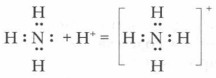
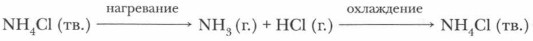
 Вспомните процесс возгонки кристаллического иода. Чем этот процесс отличается от процесса разложения хлорида аммония?
Вспомните процесс возгонки кристаллического иода. Чем этот процесс отличается от процесса разложения хлорида аммония?
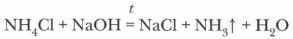
 1. Каково строение молекулы аммиака и как оно предопределяет его физические и химические свойства?
1. Каково строение молекулы аммиака и как оно предопределяет его физические и химические свойства?
 2. Изобразите схему образования иона аммония и объясните его механизм.
2. Изобразите схему образования иона аммония и объясните его механизм.
 6. Почему аммиак с кислотами реагирует активнее, чем с водой? Запишите уравнения этих реакций и раскройте их смысл.
6. Почему аммиак с кислотами реагирует активнее, чем с водой? Запишите уравнения этих реакций и раскройте их смысл.