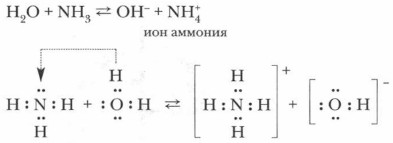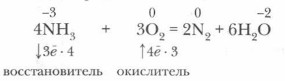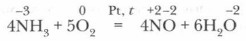|
|
|
|
|
Глава 5. Подгруппа азота и ее типичные представители § 23. Аммиак
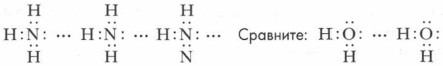
Аммиак — одно из важнейших водородных соединений азота (их у него несколько). Он имеет огромное практическое значение. Жизнь на Земле обязана своим существованием способности некоторых бактерий превращать азот воздуха в аммиак. Строение молекулы аммиака. Молекула аммиака образуется за счет ковалентных связей трех p-электронов атома азота с тремя s-электронами атомов водорода (см. рис. 27). Вследствие разницы значений ОЭО атомов азота и водорода связи N—Н полярны. Общие электронные пары смещены к атому азота как к более электроотрицательному. Три атома водорода присоединяются к атому азота так, что их связи образуют углы около 100°, т. е. молекула аммиака имеет пирамидальную форму. Одна из вершин молекулы аммиака занята неподеленной электронной парой атома азота (см. рис. 28). Молекула аммиака сильно полярна. Получение аммиака. Аммиак может быть получен несколькими способами. В лаборатории аммиак получают действием щелочей на соли аммония при нагревании (см. рис. 29).
Концентрированный раствор аммиака, поступающий в лаборатории, содержит 25% аммиака. В домашнем обиходе используется аптечный раствор «нашатырный спирт», содержащий 10% аммиака. Физические свойства аммиака. Аммиак — бесцветный газ с резким запахом, почти в два раза легче воздуха. Его относительная плотность по воздуху dв равна 0,48. При охлаждении аммиака до -33 °С он сжижается. Аммиак прекрасно растворяется в воде вследствие своей полярности (в 1 объеме воды растворяется 700 объемов аммиака), а также благодаря образованию водородных связей между молекулами аммиака и воды. Водородная связь возникает между атомом водорода одной молекулы аммиака, несущим частичный положительный заряд, и электроотрицательным атомом азота другой молекулы аммиака.
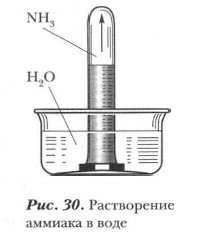
Для демонстрации хорошей растворимости аммиака в воде можно провести опыт «Фонтан», который описан при изучении растворимости хлороводо- рода в 8 классе. Растворимость аммиака еще больше, чем у НСl: в колбе создается вакуум, и немедленно начинает бить фонтан. Если добавить в раствор аммиака лакмус или фенолфталеин, они покажут не кислотный, а щелочной характер раствора, что указывает на наличие в нем гидроксид-иона.
Откуда они взялись в растворе? По всей вероятности, вследствие отнятия от молекул воды ионов водорода Н+ молекулами аммиака. Проблема. Откуда и как в данном растворе появились гидроксид-ионы? Обратимся вновь к анализу происходящего и с помощью ионных уравнений рассмотрим механизм процесса:
Задание. Попробуйте самостоятельно объяснить этот процесс.
При работе с аммиаком надо помнить, что даже незначительное содержание его приводит к раздражению слизистой оболочки носа, горла и т. д. Повышенное содержание аммиака в воздухе приводит к поражению глаз, воспалению легких.
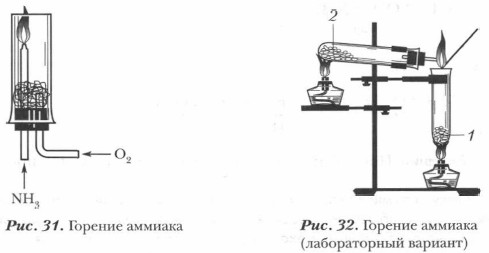
Химические свойства аммиака. Аммиак — химически активное соединение. Он вступает в реакции со многими веществами. Наиболее характерны для него реакции окисления и присоединения, что связано со степенью окисления азота (-3) в молекуле аммиака и с особенностями ее строения. 1. Реакции окисления. В окислительно-восстановительных реакциях аммиак может выступать только в качестве восстановителя. Он вступает в окислительно-восстановительную реакцию с кислородом — горит в кислороде:
Эта реакция имеет большое значение, так как лежит в основе промышленного получения азотной кислоты из аммиака.
|
|
|



 Составьте схему строения молекулы аммиака и раскройте механизм ее образования.
Составьте схему строения молекулы аммиака и раскройте механизм ее образования.
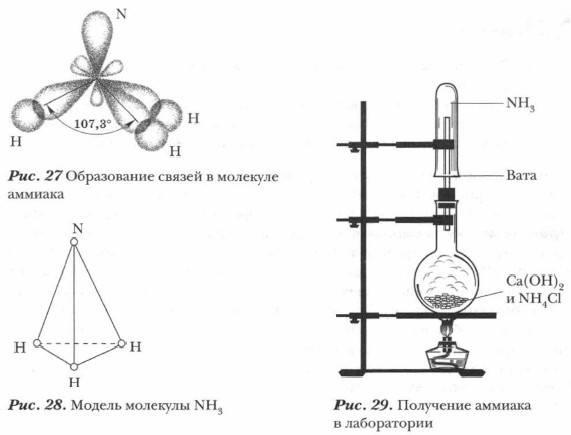
 Демонстрационный опыт. Получение аммиака. Для получения аммиака возьмем примерно равные объемы (2-3 ложки) мелкокристаллического хлорида аммония NH4Cl и твердой (лучше слегка влажной) гашеной извести Са(ОН)2. Оба порошка перемешаем в фарфоровой ступке и поместим в круглодонную колбу, заполнив ее приблизительно на 1/3 (при меньшем количестве смеси образовавшиеся при реакции капли воды будут стекать на более нагретые стенки нижней половины колбы, и она может треснуть). Осторожно нагреем колбу со смесью. Наличие аммиака определим по запаху. Выделяющийся аммиак соберем в демонстрационную пробирку способом вытеснения воздуха и проделаем с ним опыты, подтверждающие его свойства.
Демонстрационный опыт. Получение аммиака. Для получения аммиака возьмем примерно равные объемы (2-3 ложки) мелкокристаллического хлорида аммония NH4Cl и твердой (лучше слегка влажной) гашеной извести Са(ОН)2. Оба порошка перемешаем в фарфоровой ступке и поместим в круглодонную колбу, заполнив ее приблизительно на 1/3 (при меньшем количестве смеси образовавшиеся при реакции капли воды будут стекать на более нагретые стенки нижней половины колбы, и она может треснуть). Осторожно нагреем колбу со смесью. Наличие аммиака определим по запаху. Выделяющийся аммиак соберем в демонстрационную пробирку способом вытеснения воздуха и проделаем с ним опыты, подтверждающие его свойства.
 Молекулы жидкого аммиака, как и молекулы воды, могут образовывать ассоциаты за счет возникновения водородных связей:
Молекулы жидкого аммиака, как и молекулы воды, могут образовывать ассоциаты за счет возникновения водородных связей: