|
|
|
|
|
Глава 5. Подгруппа азота и ее типичные представители Фосфор как элемент и простое веществоХимические свойства. Реакции, в которые вступает фосфор, двух типов: аллотропные превращения и окислительно-восстановительные, где фосфор может быть как восстановителем, так и окислителем. 1. Фосфор — восстановитель. а) Как восстановитель фосфор реагирует с кислородом, с галогенами:
Обычно опыты проводят с красным фосфором. Он энергично сгорает в атмосфере этих окислителей. Реакции экзотермические. Белый фосфор уже при обычных условиях медленно окисляется кислородом воздуха, причем этот процесс сопровождается свечением, хорошо наблюдаемым в темноте (отсюда название фосфора — «светоносный»). б) Фосфор может окисляться и сложными веществами-окислителями:
Р + КСlO3 → Р2O5 + КСl
(Расставьте коэффициенты, используя метод электронного баланса.)
Бертолетова соль в смеси с горючим компонентом (например, с серой) содержится в головке спички, а красный фосфор наносится на боковую стенку спичечной коробки (рис. 44).
Таким образом, с помощью красного фосфора была разрешена проблема «быстрого и безопасного огня» — спичек, удобных и безопасных в обращении.
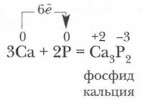
2. Фосфор — окислитель. В реакциях с активными металлами фосфор приобретает степень окисления -3. Продуктами реакции являются фосфиды:
В этом процессе восстановителем фосфора из фосфата служит уголь (кокс), а шлако- образователем — речной песок (SiO2). Он также снижает температуру восстановления фосфата и смещает равновесие в сторону образования фосфора. При конденсации выделяющихся паров образуется белый фосфор, который затем путем длительного нагревания при 280-340 °С переводится в красный. Фосфор используют для производства фосфорной кислоты. Большое его количество идет на производство спичек. В военном деле белый фосфор используют для изготовления зажигательных снарядов, дымовых шашек, снарядов и бомб, поскольку при горении фосфора образуется густой белый дым (P2O5).
Основные понятия Аллотропные модификации и превращения фосфора • Фосфор — восстановитель и окислитель Вопросы и задания
|
|
|



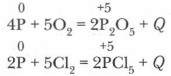
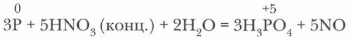
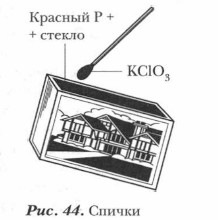
 Химическую реакцию фосфора с бертолетовой солью КСlO3 можно наблюдать, зажигая спичку:
Химическую реакцию фосфора с бертолетовой солью КСlO3 можно наблюдать, зажигая спичку:
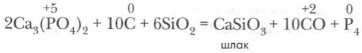
 1. Напишите уравнения реакций фосфора с бромом и серой и раскройте их сущность.
1. Напишите уравнения реакций фосфора с бромом и серой и раскройте их сущность.
 2. Чем объяснить, что элемент фосфор способен к образованию аллотропных модификаций? Опишите структуру красного и черного фосфора.
2. Чем объяснить, что элемент фосфор способен к образованию аллотропных модификаций? Опишите структуру красного и черного фосфора.
 3. Почему атомы азота при обычных условиях объединяются в двухатомные молекулы, а атомы фосфора — в четырехатомные молекулы белого фосфора или в атомные кристаллы черного и красного фосфора? Дайте объяснения.
3. Почему атомы азота при обычных условиях объединяются в двухатомные молекулы, а атомы фосфора — в четырехатомные молекулы белого фосфора или в атомные кристаллы черного и красного фосфора? Дайте объяснения.
 5. На основании знаний свойств белого фосфора прокомментируйте описание свойств белого фосрфора в романе А. Конан Дойля «Собака Баскервилей». Где здесь правда, а где вымысел?
5. На основании знаний свойств белого фосфора прокомментируйте описание свойств белого фосрфора в романе А. Конан Дойля «Собака Баскервилей». Где здесь правда, а где вымысел?