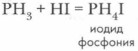|
|
|
|
|
Глава 5. Подгруппа азота и ее типичные представители § 27. Соединения фосфор
Вы уже знаете, что наиболее свойственные для фосфора соединения — те, где он проявляет степени окисления -3 и +5. Соединение фосфора с водородом. Соединение фосфора с водородом представляет собой газообразный фосфористый водород РН3, или фосфин. Фосфин — бесцветный ядовитый газ с чесночным запахом. Он самовоспламеняется на воздухе: 2РН3 + 4O2 = Р2O5 + ЗН2O Фосфин получают действием воды на фосфид кальция:
Са3Р2 + 6Н2O = ЗСа(ОН)2 + 2РН3
Наряду с фосфином часто образуется и другое водородное соединение фосфора Р2Н4, еще легче фосфина воспламеняющееся на воздухе. Это свойство водородных соединений фосфора обусловливает появление блуждающих огней на кладбищах и гниющих болотах, вызывающих страхи и суеверия, т. е. там, где происходит интенсивное, без доступа воздуха, гниение органической материи, богатой фосфором.
С сильными кислотами фосфин, как и аммиак, образует соли, в составе которых находится ион фосфония Кислородсодержащие соединения фосфора. Фосфор, как и азот, образует несколько оксидов. К наиболее важным относятся оксид фосфора (III) P2O5 и оксид фосфора (V) Р2O5. Оксиды и гидроксиды фосфора более устойчивы, чем оксиды и соответствующие им кислоты азота. 4Р + 3O2 = 2Р2O3
Это белое кристаллическое вещество, очень ядовитое. На воздухе при нагревании превращается в оксид фосфора (V) Р2O5; растворяется в воде с образованием фосфористой кислоты средней силы:
Р2O3 + ЗН2O = 2Н3РO3
Средние соли фосфористой кислоты Н3РO3 называются фосфитами, например К3РO3 — фосфит калия.
Наиболее практически важными и характерными являются кислородсодержащие соединения со степенью окисления фосфора +5.
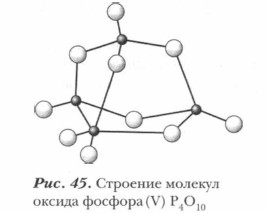
Оксид фосфора(V), или фосфорный ангидрид, вы уже хорошо знаете. Вспомните опыт сжигания фосфора в кислороде. При горении фосфора банка для его сжигания заполняется белым непрозрачным «дымом», образованным кристалликами Р2O5, которые затем конденсируются на стенках сосуда в виде белого рыхлого (снегоподобного) твердого вещества. Оксид фосфора (V) имеет способность к димеризации. Поэтому его состав в большей мере отражает формула Р4О10. Но обычно оксид фосфора (V) изображают формулой Р2O5. Его пространственная структура представлена на рисунке 45. Наиболее характерным свойством Р2O5. является его необычайная гигроскопичность, т. е. способность энергично поглощать пары воды из воздуха. При этом он сам расплывается в аморфную массу метафосфорной кислоты НРО3. Р2O5 + Н2O = 2НРО3 Это свойство оксида фосфора (V) широко используется в лаборатории для осушки газов и жидкостей, а в отдельных случаях и для отщепления от соединений химически связанной воды.
|
|
|



 Укажите формы и характер высших кислородных и водородных соединений фосфора как элемента VA-группы.
Укажите формы и характер высших кислородных и водородных соединений фосфора как элемента VA-группы.
 В воде РН3 растворим гораздо хуже аммиака, а его водные растворы, в отличие от NH3, не проявляют щелочных свойств. Почему?
В воде РН3 растворим гораздо хуже аммиака, а его водные растворы, в отличие от NH3, не проявляют щелочных свойств. Почему?
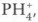 сходный с ионом аммония
сходный с ионом аммония