|
|
|
|
|
Глава 5. Подгруппа азота и ее типичные представители Соединения фосфорПри кипячении фосфорного ангидрида с водой образуется ортофосфорная кислота. Ее часто называют просто фосфорной кислотой: Р2O5 + ЗН2O = 2Н3РO4 Фосфорная кислота Н3РО4 — белое кристаллическое вещество, расплывающееся на воздухе, tпл = 42,35 °С. Она не ядовита в отличие от некоторых соединений фосфора и хорошо растворима в воде. В водных растворах фосфорная кислота диссоциирует. Это электролит средней силы. Электролитическая диссоциация фосфорной кислоты протекает ступенчато:
Суммарное уравнение:
Проблема. Наиболее полно диссоциация идет по первой ступени, каждый последующий ион Н+ отщепляется труднее. Почему ? Окислительные свойства, в отличие от HNO3 и концентрированной H2SO4, фосфорная кислота не проявляет. Она также устойчива к нагреванию. Фосфорная кислота как трехосновная способна образовывать три вида солей:
Средние соли ортофосфорной кислоты называют ортофосфатами или фосфатами. На примере фосфата натрия подтвердите, что он обладает общими свойствами солей. Напишите ионные уравнения реакций. Задание. Запишите уравнения реакций получения всех видов солей фосфорной кислоты при взаимодействии ее с гидроксидом натрия. Отразите их сущность сокращенными ионными уравнениями. (Ориентируйтесь по таблице растворимости!) Фосфаты почти всех металлов в воде нерастворимы (за исключением фосфатов щелочных металлов). Дигидрофосфаты, напротив, все хорошо растворимы в воде. Многие соли фосфорной кислоты широко применяются в сельском хозяйстве как фосфорные удобрения. В качестве минеральных удобрений используют только растворимые и хорошо усвояемые растениями соли кальция: гидро- и дигидрофосфаты. Фосфорная кислота и ее соли в растворах проявляют общие свойства соединений их классов. Получение Н3РО4. В лаборатории фосфорную кислоту Н3РO4 получают, окисляя фосфор 32 %-ной азотной кислотой:
В промышленности фосфорную кислоту получают, действуя на измельченный природный фосфат кальция серной кислотой (экстракционный метод): Ca3(PO4)2 + 3H2SO4 = 2Н3РO4 + 3CaSO4 или электротермическим методом (восстановлением фосфатов до фосфора с последующим его сжиганием и растворением в воде оксида фосфора (V)). Этот способ более экономичен и экологичен, позволяет получать более чистый продукт. Полученная таким образом фосфорная кислота идет на производство фосфорных удобрений. Итак, сравним свойства соединений азота и фосфора. Оксид фосфор а (V) и фосфорная кислота обладают большей устойчивостью и более слабыми кислотными свойствами по сравнению с аналогичными соединениями азота +5. Концентрированная Н3РO4 в отличие от HNO3 не обладает окислительными свойствами. Фосфин по сравнению с аммиаком является менее прочным соединением и отличается более слабыми основными свойствами. Эти примеры подтверждают закономерности изменения свойств элементов в главных подгруппах периодической системы. Основные понятия Оксид фосфора (V) • Ортофосфорная кислота • Соли ортофосфорной кислоты Вопросы и задания
Са3(РO4)2 → Р → Р2O5 → Са(Н2РO4)2 → Са3(РO4)2 Укажите условия их протекания.
|
|
|



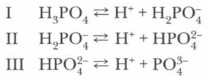
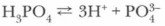

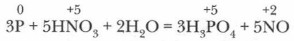
 1. Опишите строение и свойства фосфина.
1. Опишите строение и свойства фосфина.
 2. Дайте характеристику строения и свойств оксида фосфора(V). В чем причина его способности к димеризации?
2. Дайте характеристику строения и свойств оксида фосфора(V). В чем причина его способности к димеризации?
 6. Почему при действии на раствор гидроксида кальция избытка фосфорной кислоты образующийся вначале осадок исчезает? Объяснение подтвердите уравнениями реакций.
6. Почему при действии на раствор гидроксида кальция избытка фосфорной кислоты образующийся вначале осадок исчезает? Объяснение подтвердите уравнениями реакций.