|
|
|
|
|
Глава 6. Подгруппа углерода Положение элементов подгруппы углерода в периодической системе, строение их атомов
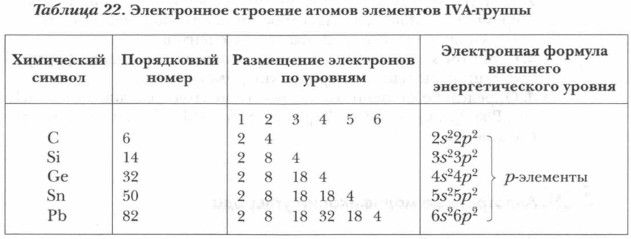
Обратимся к периодической системе химических элементов Д.И. Менделеева. В IVA-группу входят: углерод, кремний, германий, олово, свинец. Эти элементы составляют подгруппу углерода (табл. 21). Они являются самыми интересными и своеобразными по химическим свойствам элементами, так как расположены в середине периодической системы химических элементов и находятся на границе между металлами и неметаллами. История науки не знает имен первооткрывателей углерода, олова, свинца, применяемых с доисторических времен.
Каково строение атомов элементов подгруппы углерода? Положение элементов в периодической системе Д.И. Менделеева дает ключ к описанию строения их атомов. Как видно из таблицы 21, на внешнем энергетическом уровне у всех атомов элементов подгруппы углерода имеется по четыре электрона. Следовательно, высшая их степень окисления равна +4, общая форма кислородных соединений ЭО2. Отрицательная степень окисления равна -4, общая форма водородных соединений —ЭН4. Задание. Пользуясь таблицей 22, составьте электронные схемы размещения электронов по орбиталям. Сделайте вывод, какую еще степень окисления могут иметь элементы подгруппы углерода.
В основном состоянии атомы элементов подгруппы углерода имеют по два неспаренных электрона на внешнем энергетическом уровне, а так как все атомы этой подгруппы имеют на внешнем уровне свободные орбитали, то при переходе в возбужденное состояние происходит распаривание 5-электронов (см. учебник химии для 8 класса).
Углерод — неметалл, а свинец — типичный металл. Высшая положительная степень окисления +4 в этом ряду становится менее характерной, а более типичной является степень окисления +2. Для свинца характерна степень окисления +2. Отрицательная же степень окисления -4 для свинца нехарактерна. Известно соединение РbН4, которое крайне неустойчиво и разлагается уже при понижении температуры. Основные понятия Строение атома углерода • Степени окисления углерода Вопросы и задания
|
|
|



 Что вам известно об элементах IVA-группы?
Что вам известно об элементах IVA-группы?


 1. Дайте общую характеристику элементов подгруппы углерода.
1. Дайте общую характеристику элементов подгруппы углерода.
 2. Начертите схемы электронного строения атомов углерода и кремния. Основываясь на строении их атомов, перечислите общие и отличительные свойства этих элементов.
2. Начертите схемы электронного строения атомов углерода и кремния. Основываясь на строении их атомов, перечислите общие и отличительные свойства этих элементов.
 3. С учетом характерных степеней окисления составьте формулы устойчивых оксидов и хлоридов углерода и свинца.
3. С учетом характерных степеней окисления составьте формулы устойчивых оксидов и хлоридов углерода и свинца.