|
|
|
|
|
Глава 6. Подгруппа углерода § 29. Аллотропные модификации углерода
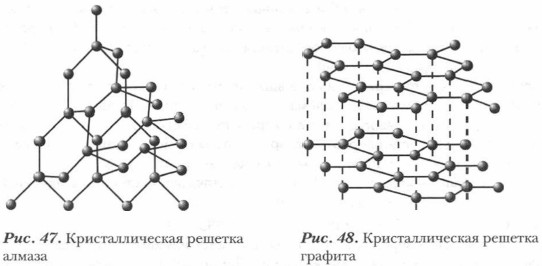
Углерод — единственный из элементов IV группы периодической системы, встречающийся в свободном состоянии. Он существует в виде нескольких аллотропных модификаций. Важнейшие из них алмаз, графит, фуллерены и карбин — это различные формы атомов одного и того же химического элемента. Различаются они, в отличие от кислорода и озона, не числом атомов в молекуле, а структурой кристаллов. Кристалл алмаза привлекает изяществом своей архитектуры: в нем все атомы углерода расположены на одинаковом расстоянии друг от друга, и каждый из них помещается в центре геометрической фигуры — тетраэдра. В четырех вершинах тетраэдра находятся соседние углеродные атомы. Эта конструкция чрезвычайно прочна, и нет поэтому в природе вещества тверже алмаза (рис. 47). Почти сто лет потребовалось, чтобы доказать тождество алмаза и углерода. В 1694 г. флорентийские ученые сожгли алмаз, нагревая его в солнечных лучах, сфокусированных линзой. Впоследствии эти опыты были многократно повторены. В 1797 г. врач Смитсон Теннант сжигает алмаз из своего перстня и приходит к выводу, что одинаковые количества алмаза и угля при сжигании дают одинаковые количества оксида углерода(IV). Несколько позже А. Лавуазье и Г. Деви также подтвердили тождество алмаза и углерода. Кристаллы алмаза бесцветны, хотя встречаются и окрашенные образцы. Они сильно преломляют свет и при огранке красиво блестят (бриллианты), поэтому из алмазов делают ювелирные украшения. Исключительной твердостью объясняется их использование для резки стекла, бурения горных пород и шлифования особо твердых материалов. Алмаз плохо проводит тепло и не проводит электрический ток.
Графит в отличие от алмаза мягок. Он легко расслаивается на отдельные чешуйки. Это связано со строением графита (рис. 48): атомы углерода располагаются в параллельных плоскостях по углам правильного шестиугольника. Расстояние же между плоскостями значительно больше, чем между соседними атомами в шестиугольнике. Поэтому одна плоскость легко отделяется от другой. Даже при слабом трении графита о бумагу на ней остается серый след («графит» означает «пишущий»). Графит непрозрачен, серого цвета, обладает металлическим блеском, проводит электрический ток. Применяется в производстве грифелей для карандашей, электродов. В смеси с техническими маслами используется в качестве смазочного материала. Графит тугоплавок, химически устойчив. Из смеси графита с глиной изготавливаются огнеупорные тигли для выплавки металлов. В ядерных реакторах графит используется в качестве замедлителя нейтронов.
|
|
|



 Что вы знаете об углероде — простом веществе?
Что вы знаете об углероде — простом веществе?