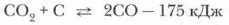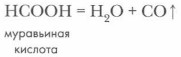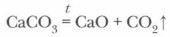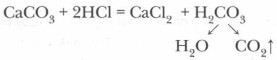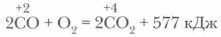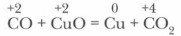|
|
|
|
|
Глава 6. Подгруппа углерода § 31. Оксиды углерода
В соответствии с возможными степенями окисления атома углерод образует два оксида: оксид углерода (II) — угарный газ и оксид углерода (IV) — углекислый газ.
Задание. Объясните механизм образования химических связей в молекуле оксида углерода (II). Получение оксидов углеродаС + O2 = СО2 + 402 кДж
Образующийся оксид углерода (IV) проходит через слои раскаленного кокса и восстанавливается до оксида углерода (II) СО:
Состав полученных генераторных газов зависит от природы окислителя (вида дутья), типа газифицируемого топлива и режима процесса. Наиболее богаты оксидом углерода (II) водяной (до 36%) и парокислородный (до 66%) генераторные газы. Превращение твердого топлива в газообразное называется газификацией топлива.
В лаборатории оксид углерода (II) СО получают из муравьиной кислоты при нагревании в присутствии концентрированной серной кислоты как водоотнимающего средства:
Оксид углерода (IV) в промышленности получают прокаливанием известняка:
В лаборатории же оксид углерода (IV) СO2 получают действием соляной кислоты на твердые карбонаты (рис. 51).
Физические и химические свойства оксида углерода (II)Оксид углерода (II) СО, или угарный газ, — бесцветный газ, без запаха, немного легче воздуха, плохо растворим в воде. Сильный яд! Оксид углерода (II) при попадании в организм прочнее соединяется с гемоглобином, чем кислород, и кровь перестает подавать кислород к клеткам тканей организма. Возникает кислородное голодание. При сильном отравлении возможен смертельный исход. Допустимое содержание СО в производственных помещениях составляет 0,03 мг в 1 л воздуха. Противоядие — свежий воздух, искусственное дыхание, при сильном отравлении — переливание крови. Оксид углерода (II) при обычных условиях весьма инертен. Он не взаимодействует с водой, кислотами и щелочами, является несолеобразующим оксидом. Для углерода характерна степень окисления +4, она более устойчива, поэтому оксид углерода (II) проявляет восстановительные свойства:
Как восстановитель он широко применяется в металлургической промышленности для получения металлов:
Оксид углерода (II) горит синим пламенем с выделением большого количества теплоты.
|
|
|



 Исходя из положения углерода в периодической системе химических элементов Д.И. Менделеева, охарактеризуйте химические свойства оксидов углерода.
Исходя из положения углерода в периодической системе химических элементов Д.И. Менделеева, охарактеризуйте химические свойства оксидов углерода.

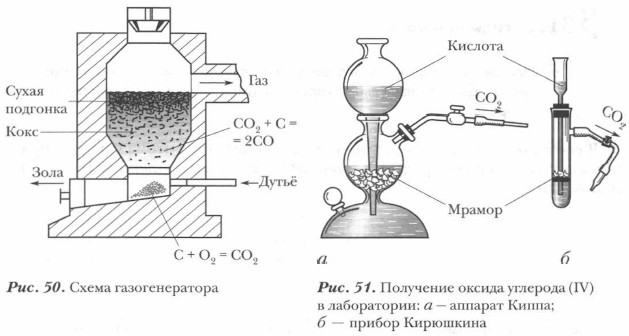
 Оксид углерода (II) в промышленности получают в специальных газогенераторах (рис. 50). Рассмотрим наиболее распространенный газогенератор шахтного типа. В газогенератор загружают твердое топливо (кокс), снизу подается дутьё:
Оксид углерода (II) в промышленности получают в специальных газогенераторах (рис. 50). Рассмотрим наиболее распространенный газогенератор шахтного типа. В газогенератор загружают твердое топливо (кокс), снизу подается дутьё: