|
|
|
|
|
Глава 7. Общие сведения об органических соединениях Электронное и пространственное строение углеводородов
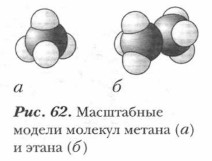
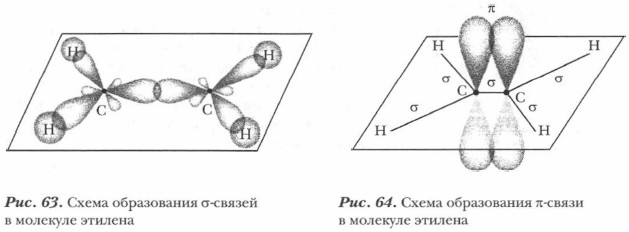
Существуют еще масштабные модели углеводородов, в которых атомные частицы изображают в виде сплющенных шаров в соответствии с межъядерными расстояниями (рис. 62). Непредельные углеводороды. В отличие от предельных (насыщенных) углеводородов существуют углеводороды, в молекулах которых между атомами углерода имеются кратные (двойные и тройные) ковалентные связи. Это непредельные (ненасыщенные) углеводороды — алкены и алкины. Простейшие их представители — это этилен С2Н4 и ацетилен С2Н2. Образование двойной связи. В молекуле этилена СН2СН2 в гибридизации у каждого атома углерода участвуют одна s- и две р-орбитали. Это sp2-гибридизация. Образуются три гибридные орбитали. Физико-химическими способами установлено, что молекула этилена имеет плоскостное строение. Три гибридные орбитали лежат в одной плоскости и расположены под углом 1 20° (рис. 63). Они участвуют в образовании простых (одинарных) связей — σ- связей. Одна р-орбиталь у каждого атома углерода не участвует в гибридизации. Негиб- ридизованные р-орбитали располагаются перпендикулярно плоскости σ-связей. Они перекрываются, образуя качественно новую связь — π (пи)-связь (рис. 64).
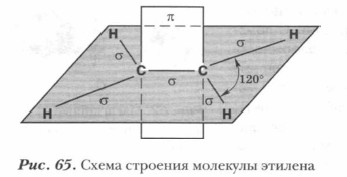
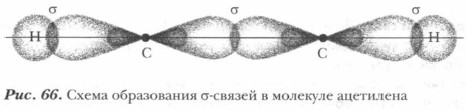
π-Связь — это ковалентная связь, образованная за счет негибридизованных орбиталей, при этом перекрывание орбиталей происходит по обе стороны от связи, соединяющей атомы, причем плоскость симметрии π-связи перпендикулярна плоскости симметрии σ-связи. Таким образом, в молекуле этилена пять σ-связей (четыре связи С—Н и одна связь С—С) и одна π-связь (связь С—С) (рис. 65). Двойная связь С=С между атомами углерода в молекуле этилена образована: σ-связью и одной π-связью. Образование тройной связи. Рассмотрим электронное и пространственное строение молекулы ацетилена НС = СН. В молекуле ацетилена в гибридизацию вступают у каждого атома углерода одна s- и одна р-орбиталь — это sp-гибридизация. При этом образуются две гибридные орбитали. Экспериментальные данные показывают, что молекула ацетилена линейная, следовательно, две гибридные орбитали располагаются на одной линии, т. е. под углом 180° (рис. 66).
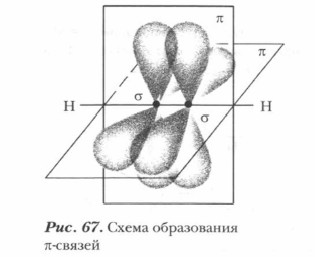
Две негибридизованные р-орбитали располагаются в двух взаимно перпендикулярных плоскостях (рис. 67), образуя две π-связи. Между атомами углерода в молекуле ацетилена находится тройная связь С = С, одна σ-связь и две π-связи. Двойные и тройные ковалентные связи получили название кратных ковалентных связей. Из таблицы 25 видно, что энергия π-связи меньше, чем энергия σ-связи. Чем больше энергия связи, тем она прочнее. Поэтому при химических реакциях в первую очередь разрываются π-связи как менее прочные.
|
|
|



 Лабораторный опыт. Изготовление моделей молекул углеводородов. С помощью пластилина и спичек, по возможности соблюдая направление связей и валентные углы, соберите шаростержневые модели молекул пропана и бутана. Убедитесь на опыте, что алканы имеют зигзагообразное строение.
Шаростержневые модели углеводородов являются упрощенными и не дают представления об относительных размерах атомных частиц и межъядерных расстояниях.
Лабораторный опыт. Изготовление моделей молекул углеводородов. С помощью пластилина и спичек, по возможности соблюдая направление связей и валентные углы, соберите шаростержневые модели молекул пропана и бутана. Убедитесь на опыте, что алканы имеют зигзагообразное строение.
Шаростержневые модели углеводородов являются упрощенными и не дают представления об относительных размерах атомных частиц и межъядерных расстояниях.