|
|
|
|
|
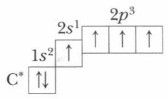
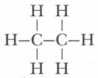
Глава 7. Общие сведения об органических соединениях § 37. Электронное и пространственное строение углеводородовПредельные углеводороды. Электронное и пространственное строение предельных углеводородов (алканов) начнем рассматривать с простейшего их представителя — метана СН4. В метане атом углерода находится в возбужденном состоянии, т. е. в состоянии с более высокой энергией:
В возбужденном состоянии один из валентных электронов находится на 2s-орбитали, которая имеет форму шара, а три других электрона — на трех 2р-орбиталях, которые имеют гантелеобразную форму. При образовании химических связей, например с атомами водорода, должно образоваться четыре С—Н связи: одна s—s-связь и три s—р-связи. Однако экспериментально доказано, что в молекуле метана все четыре ковалентные связи С—Н равноценны:
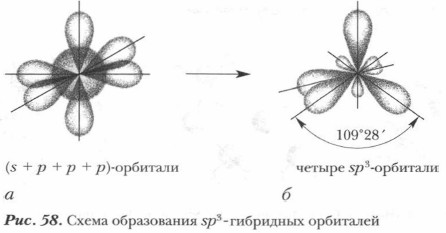
Устранение этого противоречия стало возможным с появлением теории гибридизации (смешения) электронных орбиталей (американский ученый Л. Полинг, 1931 г.). Согласно теории гибридизации при образовании химических связей электронные орбитали атома взаимодействуют между собой (смешиваются) и образуют такое же число гибридных орбиталей с одинаковой энергией и формой (как до смешения). Если в гибридизации участвуют одна s- и три р-орбитали (рис. 58, а), то такая гибридизация называется sp3 - гибридизацией. Образуются четыре гибридные орбитали, которые в пространстве взаимно отталкиваются, их оси оказываются направленными к вершинам тетраэдра с углом между ними 109°28' (рис. 58, 6).
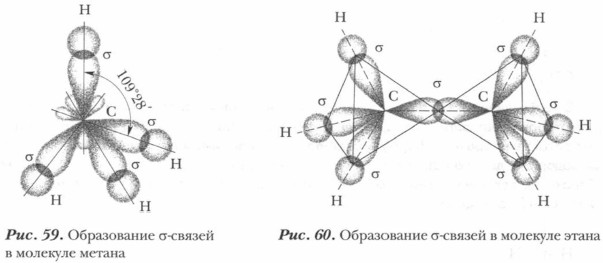
Химические связи в молекуле метана образованы за счет перекрывания каждой гибридной орбитали атома углерода с s-орбиталями четырех атомов водорода по линии, соединяющей ядра атомов. Подобный тип ковалентной связи получил название σ (сигма)-связи (рис. 59).
σ-Связь — это ковалентная связь, образующаяся вследствие перекрывания орбиталей по оси, соединяющей связываемые атомы. Чем больше объем перекрывания, тем прочнее связь. σ-Связь — самая прочная из ковалентных связей. Так как в образовании каждой σ-связи в молекуле метана участвует по одной паре электронов, то такую связь еще называют простой (одинарной) связью. Рассмотрим строение следующего углеводорода — этана С2Н6:
В молекуле этана семь ковалентных связей: шесть из них связи С—Н и одна С—С. Все они σ-связи. Атомы углерода в этане, как и в метане, находятся в sp3-гибридизованном состоянии (рис. 60). Валентные углы между связями близки к тетраэдрическим (109°28'). Поэтому углеродный остов молекулы предельного углеводорода имеет не линейное, а зигзагообразное строение. Зигзагообразная цепь атомов углерода может принимать различные пространственные формы. Это связано с тем, что атомы в молекулах предельных углеводородов могут свободно вращаться вокруг σ-связей (рис. 61). Такие модели углеводородов называются шаростержневыми.
|
|
|