|
|
|
|
|
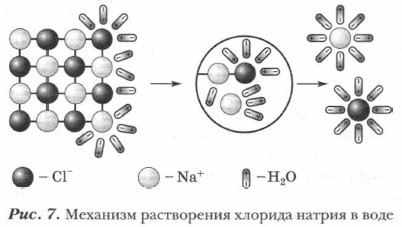
Глава 2. Растворы. Теория электролитической диссоциации Ионы — переносчики электрических зарядовЗадание. Вспомните особенности строения молекул воды (полярная связь, угловое строение, дипольный характер) и рассмотрите рисунок 7, изображающий механизм растворения хлорида натрия NaCl в воде. Попробуйте объяснить механизм разрушения ионного кристалла в воде — полярном растворителе.
Объяснения можно свести к положениям современной теории электролитической диссоциации.
Приведем примеры записи сущности процессов электролитической диссоциации электролитов с ионной связью:
Такие уравнения называются уравнениями электролитической диссоциации. Ионы (анионы и катионы), окруженные оболочками из молекул воды, называются гидратированными и обозначаются aq — двумя первыми буквами латинского названия воды — aqua. Процесс образования таких ионов называется гидратацией. Этот процесс всегда сопровождает растворение в воде ионных соединений. Однако указание на то, что образуются гидратированные ионы, при записи уравнений электролитической диссоциации нередко опускается. Например:
Коэффициенты в таких уравнениях указывают на число ионов, а цифры со знаком «+» или «-» обозначают заряды ионов. Заряды ионов можно установить по таблице растворимости. Если вместо воды используются иные растворители (аммиак, этиловый спирт, серная кислота и т. п.), то процесс образования вокруг ионов оболочек молекул растворителя называется сольватацией, а ионы, окруженные оболочками, — сольватированными. Основные понятия Электролиты • Неэлектролиты • Электролитическая диссоциация • Гидратация • Гидратированные ионы • Сольватация Вопросы и задания
|
|
|



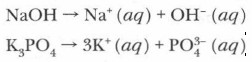
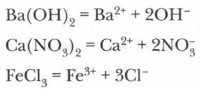
 1. Опишите механизм растворения в воде бромида калия КВr.
1. Опишите механизм растворения в воде бромида калия КВr.
 2. Если взять ряд веществ: NaOH, BaSO4, КСl, Са(ОН)2, AgBr, поместить их в химические стаканы, добавить воду, размешать, после чего в каждый стакан поочередно опустить электроды прибора для проверки электропроводности, то в каких случаях лампочка не загорится? Почему?
2. Если взять ряд веществ: NaOH, BaSO4, КСl, Са(ОН)2, AgBr, поместить их в химические стаканы, добавить воду, размешать, после чего в каждый стакан поочередно опустить электроды прибора для проверки электропроводности, то в каких случаях лампочка не загорится? Почему?
 3. Определите, на какие ионы распадаются следующие соединения: CuCl2, KMnO4, NaBr, Са(ОН)2, Fe(NO3)3, Na3PO4, Al2(SO4)3, AgNO3, ZnSO4, AlCl3, Mg(NO3)2.
3. Определите, на какие ионы распадаются следующие соединения: CuCl2, KMnO4, NaBr, Са(ОН)2, Fe(NO3)3, Na3PO4, Al2(SO4)3, AgNO3, ZnSO4, AlCl3, Mg(NO3)2.
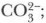 б) Сr3+ и
б) Сr3+ и  в) Fe2+ и Сl-.
в) Fe2+ и Сl-.
 6. Составьте перечень анионов и катионов, присутствующих в морской воде. Известны ли вам примеры получения из морской воды каких-либо простых или сложных веществ?
6. Составьте перечень анионов и катионов, присутствующих в морской воде. Известны ли вам примеры получения из морской воды каких-либо простых или сложных веществ?