|
|
|
|
|
Глава 2. Растворы. Теория электролитической диссоциации § 4. Ионы — переносчики электрических зарядов
Сформулируйте определение иона. Что означают термины «анион», «катион»? (См. учебник химии для 8 класса.) Из курса физики вы уже знаете, что некоторые вещества, в том числе и водные растворы кислот, солей и оснований, проводят электрический ток. Их называют электролитами или проводниками второго рода (рис. 5). Все вещества по способности их растворов и расплавов проводить электрический ток подразделяются на две группы — электролиты и неэлектролиты:
Электрическую проводимость (электропроводность) раствора можно определить с помощью прибора, изображенного на рисунке 6. Лампочка прибора загорается только в случае замыкания электрической цепи. А цепь замыкается только при условии погружения электродов в раствор (расплав) электролита.
Знания о строении веществ во времена Фарадея не позволяли вскрыть истинные причины образования ионов при растворении и расплавлении веществ. Дальнейшее развитие физики и химии растворов позволило установить следующее.
Механизм электролитической диссоциации веществ с ионной связью
Какие связи удерживают ионы в узлах кристаллической решетки? Раскройте содержание понятия «диполь». Если мы для проверки электропроводности последовательно опустим электроды прибора (не забывая каждый раз промывать их в дистиллированной воде) в растворы гидроксида натрия, хлорида калия, бромида натрия и т. д., то загорание лампочки будет свидетельствовать о том, что данные растворы проводят ток, что говорит о наличии в них ионов. Проблема. Современная теория электролитической диссоциации говорит о том, что при растворении в воде электролиты распадаются на ионы. Почему же разрушаются прочные ионные кристаллы?
Так что же заставляет кристаллы соли или щелочи распадаться на ионы при их попадании в растворитель? Оказывается, сам растворитель, в данном случае — это вода. |
|
|



 Вспомните, сколько видов ионов существует в зависимости от знака заряда.
Вспомните, сколько видов ионов существует в зависимости от знака заряда.
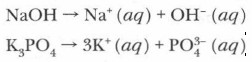

 Электропроводность растворов была обнаружена в начале XIX в. М. Фарадеем. Исследовав это явление, великий английский ученый сделал абсолютно верный вывод, что переносчиками тока являются ионы. Однако он ошибочно считал, что ионы образуются под действием электрического тока (знаменитая «ошибка Фарадея»).
Электропроводность растворов была обнаружена в начале XIX в. М. Фарадеем. Исследовав это явление, великий английский ученый сделал абсолютно верный вывод, что переносчиками тока являются ионы. Однако он ошибочно считал, что ионы образуются под действием электрического тока (знаменитая «ошибка Фарадея»).