|
|
|
|
|
Глава 8. Общие свойства металлов Элементы-металлы. Особенности строения их атомов. Положение металлов в периодической системе Д.И. МенделееваМеталлы — простые вещества, их строение и свойства
Вы знакомы со многими металлами. Все металлы, за исключением ртути, при обычных условиях являются твердыми веществами. Металлы в кристаллическом состоянии обладают общими физическими свойствами: металлическим блеском, непрозрачностью, пластичностью, хорошей электро- и теплопроводностью. Такими общими свойствами в комплексе не обладают неметаллы, а также химические соединения с ковалентной и ионной связью. Свойства веществ зависят от строения. Проблема. Какова химическая связь атомов в металле? Для решения данной проблемы обратимся к строению атомов металлов. Главной особенностью атомов металлов является наличие у них на внешних энергетических уровнях небольшого числа электронов (один, два, реже три или четыре). Еще меньше на этих уровнях имеется неспаренных электронов, сравнительно слабо связанных с ядром атома и обладающих низкой энергией ионизации. Этих электронов у атома металла явно недостаточно, чтобы с другим атомом образовать прочную связь и достичь устойчивой восьмиэлектронной конфигурации (как в случае образования ковалентной связи). Задание. Составьте схему образования молекулы лития Li2, раскройте механизм ее образования.
При образовании общей электронной пары, связывающей атомы лития
не достигается устойчивая структура внешнего слоя. Следовательно, молекулярное состояние для металлов не является энергетически выгодным. Очевидно, что для металлов характерен иной вид химической связи.
Итак, внешних и особенно неспаренных электронов у атомов металлов явно недостаточно, чтобы образовать устойчивую восьмиэлектронную конфигурацию атома. В этом случае для ее образования требуются электроны множества атомов металлов, которые «сбрасывают» свои неспаренные электроны в общее пользование. Эти электроны оказываются принадлежащими всем участвующим в этом процессе атомам. Между ними устанавливается связь, называемая металлической. Ее обеспечивают свободно перемещающиеся в объеме металла электроны, принадлежащие всем атомам, в виде «электронного газа».
Результатом связывания атомов металлов является образование кристалла металла. Следствием свободного перемещения электронов и являются характерные физические свойства: теплопроводность, электропроводность и др. Металлическая связь достаточно прочная, у лития ее энергия равна 317 кДж/моль (сравните: энергия ковалентной химической связи у молекулы Li2 равна 108 кДж/моль). Атомы металла, «сбросившие» валентные электроны, превращаются в положительно заряженные ионы — катионы, которые могут вновь притягивать к себе электроны из электронного газа и превращаться в нейтральные атомы:
Следовательно, система «атом — ион» очень подвижна.
Основные понятия Строение атомов металлов • Металлическая связь Вопросы и задания
|
|
|



 Опишите внешний вид металлов (медь, алюминий, ртуть).
Опишите внешний вид металлов (медь, алюминий, ртуть).
 Экспериментально доказано, что в парообразном состоянии некоторые металлы находятся в виде двухатомных ковалентных молекул, например Li2. Энергия связи в таких молекулах невелика по сравнению с подобными молекулами неметаллов (у Li2 она равна 108 кДж/моль, тогда как у H2 — 438 кДж/моль).
Экспериментально доказано, что в парообразном состоянии некоторые металлы находятся в виде двухатомных ковалентных молекул, например Li2. Энергия связи в таких молекулах невелика по сравнению с подобными молекулами неметаллов (у Li2 она равна 108 кДж/моль, тогда как у H2 — 438 кДж/моль).
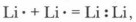
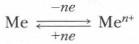
 1. Сравните физические свойства простых веществ: магния и серы.
1. Сравните физические свойства простых веществ: магния и серы.
 3. Какая связь называется металлической и как она образуется?
3. Какая связь называется металлической и как она образуется?