|
|
|
|
|
Глава 8. Общие свойства металлов § 47. Элементы-металлы. Особенности строения их атомов. Положение металлов в периодической системе Д.И. МенделееваУже с древних времен человек знал и применял многие металлы. С развитием науки и техники расширялись знания о структуре и свойствах металлов, о способах их получения и областях применения. Развитию химии металлов и металлургии в значительной степени способствовал тот факт, что металлы в земной коре распространены довольно широко. Металлы приобрели большое значение в современной технике и быту. Развитие химии металлов стало важным фактором научно-технического прогресса.
Характер элемента определяется прежде всего внешними валентными электронами его атомов. Для элементов-металлов характерно небольшое число электронов на внешнем энергетическом уровне (обычно 1-2, реже 3-4). Из 111 известных элементов 87 элементов — металлы, т. е. большинство. Металлы расположены в начале периодов в I-III группах и в четных рядах больших периодов. Период начинается элементами-металлами (за исключением I периода).
Для того чтобы определить, является ли элемент металлом, следует учитывать такие его характеристики:
Зная важнейшие характеристики металлических элементов, можно дать им разностороннее описание. Итак, к элементам-металлам относятся: элементы I—II групп, все s-и d-элементы (кроме водорода), а также некоторые p-элементы главных подгрупп III—VII групп (в III группе все элементы, кроме бора, — металлы; в IVA-rpynne к металлам относятся Ge, Sn, Pb; в VA-группе металлами являются сурьма Sb, висмут Bi; в VIA-группе — полоний Ро; в VIIA-группе — астат At). Если в периодической системе (короткопериодной) провести мысленно диагональ от бериллия к астату, то элементы-металлы займут в ней всю левую нижнюю часть, переходя иногда за диагональную линию. Элементы, расположенные вблизи диагонали, обладают двойственными (амфотерными) свойствами (Be, Al, Ti, Ge, Nb и др.).
|
|
|



 Какие элементы относят к металлам? Каковы особенности строения их атомов?
Какие элементы относят к металлам? Каковы особенности строения их атомов?
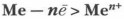
 Процесс отрыва электронов от атомов металлов — эндотермический, требующий затраты энергии, т. е. энергии ионизации. С наименьшей затратой энергии отрывается первый электрон от нейтрального атома. Если на внешнем слое у атома более одного электрона, то для отрыва второго, третьего и т. д. электронов потребуется больше энергии, так как они отрываются уже не от нейтрального атома, а от заряженной частицы. Энергия ионизации — важная характеристика атомов элементов, особенно металлов. Она подчинена периодическим закономерностям: в периоде она возрастает слева направо, в подгруппе, наоборот, уменьшается. (Подробнее об энергии ионизации см. учебник химии для 8 класса.)
Процесс отрыва электронов от атомов металлов — эндотермический, требующий затраты энергии, т. е. энергии ионизации. С наименьшей затратой энергии отрывается первый электрон от нейтрального атома. Если на внешнем слое у атома более одного электрона, то для отрыва второго, третьего и т. д. электронов потребуется больше энергии, так как они отрываются уже не от нейтрального атома, а от заряженной частицы. Энергия ионизации — важная характеристика атомов элементов, особенно металлов. Она подчинена периодическим закономерностям: в периоде она возрастает слева направо, в подгруппе, наоборот, уменьшается. (Подробнее об энергии ионизации см. учебник химии для 8 класса.)