|
|
|
|
|
Дополнительный материал к главе 8 Коррозия металлов и сплавовМеталлы и сплавы подвержены разрушению под воздействием окружающей среды. Причина этого разрушения лежит в химических свойствах металлов — в их способности вступать в окислительно-восстановительные реакции с веществами окружающей среды и окисляться. Самопроизвольное разрушение металлов и металлических материалов (сплавов) под воздействием окружающей среды называется коррозией. Термин «коррозия» происходит от латинского слова corrosio — «разъедание». Общеизвестным примером коррозии является ржавление железа. Количество металлических материалов, используемых в народном хозяйстве, очень велико. Коррозии подвержены многие металлы и их сплавы (железо, алюминий, медь, свинец и др.). Стойкими против коррозии являются лишь благородные металлы: серебро, золото, платина. Коррозия приводит не только к полной потере металлических изделий, но и к потере металлами многих ценных качеств (твердости, пластичности и др.). Ежегодно из-за коррозии в мире безвозвратно теряется огромное количество металла, более 20 млн тонн. Еще более существенны экономические потери, связанные с порчей изделий из-за коррозии, затраты на ремонт, замену деталей, аппаратуры, приборов, которые во много раз превышают стоимость металлов, из которых они изготавливаются. Много и косвенных потерь из-за коррозии металлов: порча продуктов питания, утечки газа, нефти из испорченных трубопроводов и т. д. Поэтому борьба с коррозией является важнейшей проблемой человечества. Чтобы бороться с коррозией, надо знать сущность этого процесса, механизм его протекания, условия, ускоряющие и замедляющие разрушение металла. Проблема. К каким процессам относится коррозия, в чем ее суть, каковы причины возникновения и условия протекания этого процесса? Существуют разные виды коррозии металлов и их сплавов. Наиболее распространены два вида: а) химическая коррозия и б) электрохимическая. Химическая коррозия — это вид коррозии, обусловленный непосредственным взаимодействием металла или сплава с сухими газами, жидкостями, не являющимися электролитами, твердыми веществами. Суть ее заключена в окислении металла в процессе непосредственного химического взаимодействия с веществами окружающей среды (газовая, жидкостная коррозия). Примером газовой коррозии может служить окисление железа в атмосфере хлора: 2Fe + ЗСl2 = 2FeCl3 или окисление кислородом воздуха. При окислении воздухом на поверхности некоторых металлов образуются пленки из тончайшего слоя оксидов, защищающие в дальнейшем эти металлы от коррозии. Например, такая пленка возникает на поверхности никеля, хрома, меди, алюминия и других металлов. Для предотвращения коррозии на поверхности некоторых металлов специально создают такую защитную пленку, но более плотную, т. е. металл пассивируют (железо, хром, титан и другие металлы и их сплавы).
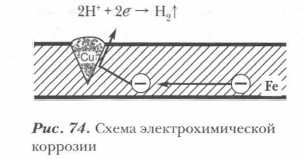
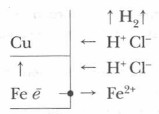
Электрохимическая коррозия — наиболее распространенный вид коррозии, приносящий наибольший вред металлам и изделиям из них. Электрохимическая коррозия возникает при контакте двух и более металлов одного сплава или металла с поверхностью изделия из другого металла в присутствии воды или другого электролита. В этом случае образуется гальванический элемент, электродами которого и являются металлы, находящиеся в растворе электролита (вода, в которой растворен углекислый газ, кислоты и др.). Возникает электрохимический процесс, т. е. наряду с химическими процессами, связанными с отдачей электронов и окислением металла, протекают и электрические (перенос электрона от одного участка металла к другому (рис. 74). При возникновении гальванической пары сила возникающего электрического тока тем больше, чем дальше стоят друг от друга металлы в ряду напряжений. При этом поток электронов от более активного металла идет к металлу менее активному. Более активный металл при этом разрушается. Так, в паре Fe — Zn разрушается цинк; в паре Сu — Pt корродирует медь. Схема действия гальванической пары (случай контактной коррозии, кусочек меди на железной поверхности, среда — кислая):
Примеры процессов электрохимической коррозии:
При контакте железа с оловом наблюдается обратная картина: интенсивность коррозии железа увеличивается.
|
|
|