|
|
|
|
|
Дополнительный материал к главе 8 Коррозия металлов и сплавов (окончание)Электрохимическая коррозия усиливается в присутствии сильных электролитов, при наличии в металле примесей, в том числе другого металла. Коррозия осуществляется и в слабых электролитах, но ее скорость в сильных выше. Так, корродирующее действие водопроводной воды как слабого электролита усиливается, если в ней растворены атмосферные газы — углекислый газ, сернистый газ. Наличие их особенно ощутимо в промышленных районах, вблизи железных и автомобильных дорог. Химическая коррозия существенно усиливается при высоких температурах (в металлургии, в ракетных двигателях и газовых турбинах при их работе). Коррозия приносит огромный ущерб хозяйству страны. Только прямые потери железа от коррозии составляют около 10% его ежегодной выплавки. Поэтому большое внимание придается мерам борьбы с коррозией. Способы защиты от коррозии1. Поверхностные защитные покрытия металлов:
В случае металлических покрытий в зависимости от роли каждого металла в гальванической паре различают покрытия анодные и катодные. К анодным покрытиям относят металлы более активные, электродный потенциал которых по алгебраической величине меньше, чем у защищаемого металла (например, анодным покрытием для железа служит цинк). К катодным покрытиям, наоборот, относят защитные металлы с более высокими, чем у защищаемых, значениями электродных потенциалов (например, для железа и стали катодными покрытиями являются олово, никель, медь и др.; в данном случае быстрее разрушается железо). Металлические покрытия можно наносить разными способами (гальванические горячие покрытия, металлизация и др.). 2. Создание сплавов, стойких к коррозии. Достигается введением в состав стали хрома, марганца, никеля (нержавеющая сталь). Изготавливают антикоррозийные сплавы, содержащие до 1 2 % Сг, а также сплавы с добавками никеля, кобальта, меди и других металлов.
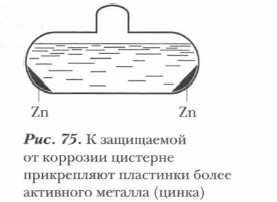
3. Протекторная защита. Сущность протекторной защиты заключается в том, что металлическую конструкцию (подземный трубопровод, корпус судна и т. д.), находящуюся в растворе электролита (подземные и почвенные воды, морская вода и т. д.), соединяют с протектором — более активным металлом, чем металл защищаемой конструкции; в процессе коррозии протектор служит анодом и разрушается, предохраняя от разрушения конструкцию. В качестве протектора для стальных конструкций обычно используют алюминий, цинк, магний и их сплавы (рис. 75). Ниже приведен вариант схемы-конспекта, которая поможет вам обобщить и систематизировать изученное, послужит опорой для дальнейшего использования этих знаний (схема 4, а также табл. 35).
|
|
|