|
|
|
|
|
Глава 9. Металлы главных и побочных подгрупп § 50. Характеристика s-элементов IA-группы периодической системы и образуемых ими простых веществПо форме орбиталей валентных электронов металлические элементы принято делить на три группы: s-, р- и d-элементы. В этой главе наибольшее внимание уделено подробному ознакомлению с элементами главных подгрупп I и II групп периодической системы Д.И. Менделеева, кратко рассмотрены свойства металлов, принадлежащих к семействам р- и d-элементов, а также конкретные их представители.
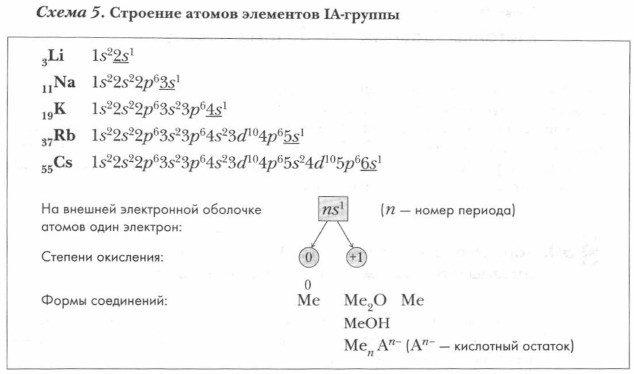
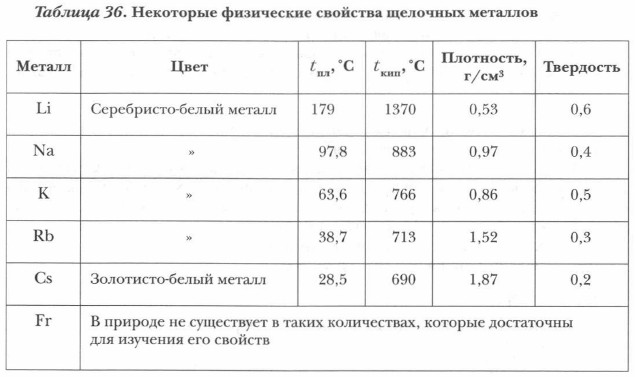
Атомы химических элементов, начинающих периоды, имеют один s-элек- трон на внешнем энергетическом уровне, поэтому в соединениях они проявляют постоянную валентность I и степень окисления +1. Подгруппа щелочных металлов подчиняется общей закономерности периодической системы: по мере увеличения порядкового номера усиливаются восстановительные свойства металлов. Причиной этого является увеличение радиуса атомов вследствие возрастания числа электронных слоев и усиления их экранирующего влияния (электроны, располагающиеся на внутренних энергетических уровнях, заслоняют ядро от валентных электронов и ослабляют силы притяжения, действующие между ними). Наличие всего одного валентного электрона и относительно большие размеры радиусов атомов обусловливают небольшую энергию ионизации, а следовательно, высокую химическую активность щелочных металлов. Физические свойства щелочных металлов. Высокая химическая активность щелочных металлов требует особой осторожности при их хранении и применении. Поверхность всех щелочных металлов покрыта пленкой: литий — тонкой, плотной, черного цвета; натрий — довольно толстой, светло-серого цвета; калий — темно-серой с зеленовато-фиолетовым оттенком, в мелких складчатых морщинках. Эти пленки пористые и рыхлые, именно поэтому они не защищают металлы от дальнейшего окисления.
Если отрезать от кусочков лития, натрия, калия по стружке, то весьма недолгое время можно наблюдать красивую блестящую серебристо-белую (у калия — с фиолетовым оттенком) поверхность металлов. Одновременно можно рассмотреть появление и быстрое распространение блестящей матовой пленки, состоящей из продуктов окисления металлов.
Для щелочных металлов характерна низкая твердость, вернее — мягкость. Труднее всего разрезать литий, тогда как натрий и калий очень легко поддаются скальпелю. На основании таблицы 36 сделайте выводы о физических свойствах щелочных металлов и характере их изменения внутри группы. Данные таблицы 36 показывают, что для всех щелочных металлов характерны малая плотность, низкая температура кипения и плавления, незначительная твердость. На основании изучения характера изменения физических свойств можно сделать следующий вывод:
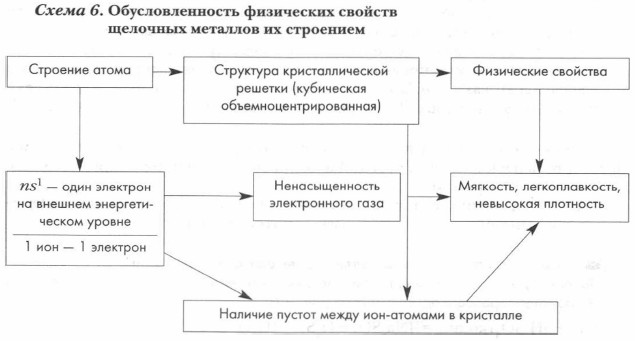
Особенности строения щелочных металлов. Металлические кристаллические решетки щелочных металлов характеризуются рядом особенностей. Во-первых, каждый атом щелочных металлов располагает лишь одним валентным электроном, следовательно, в кристаллах на один ион-атом приходится один свободный электрон. Во-вторых, для рассматриваемой группы металлов характерна неплотная упаковка атомов в кристалле, тип решеток — кубические объемноцентрированные (см. рис. 72). Зависимость свойств щелочных металлов от их строения отражена в схеме 6.
Исследования показали, что между ионами щелочных металлов имеются значительные пустоты. Например, диаметр иона натрия равен 0,1 89 нм, а расстояние между ядрами соседних ионов составляет 3,71 нм, следовательно, в кристалле между ион-атомами имеется зазор, равный 0,1 81 нм. Это также способствует ослаблению сил связывания ионов.
|
|
|



 С помощью схемы 5 проанализируйте строение электронных оболочек атомов химических элементов, образующих IA-группу. Охарактеризуйте важнейшие общие свойства элементов.
С помощью схемы 5 проанализируйте строение электронных оболочек атомов химических элементов, образующих IA-группу. Охарактеризуйте важнейшие общие свойства элементов.
 В лабораторных условиях литий, натрий и калий обычно хранятся под слоем керосина, защищающего их от контакта с воздушной средой. Рубидий и цезий не используют в школьных лабораториях: это весьма редкие и дорогие вещества; их чрезвычайно высокая химическая активность очень усложняет работу с ними.
В лабораторных условиях литий, натрий и калий обычно хранятся под слоем керосина, защищающего их от контакта с воздушной средой. Рубидий и цезий не используют в школьных лабораториях: это весьма редкие и дорогие вещества; их чрезвычайно высокая химическая активность очень усложняет работу с ними.