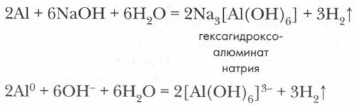|
|
|
|
|
Глава 9. Металлы главных и побочных подгрупп § 53. Алюминий
Алюминий — один из наиболее распространенных в природе элементов. На его долю приходится 8,13% массы земной коры. В основном он сосредоточен в минералах, называемых алюмосиликатами. К их числу относятся как обыкновенные глины и слюда, так и замечательные драгоценные камни, такие как гранат, берилл, топаз. Обратитесь к схеме 8, где дана характеристика алюминия. Важнейшими минералами алюминия, имеющими промышленное значение, являются бокситы (Аl2O3 • Н2O), криолит (Na3AlF6.) и др.
На поверхности алюминия тонкая и прочная, но отслаивающаяся при механическом воздействии (сгибании — разгибании) пленка. Ее толщина всего 0,00001 мм, но она надежно защищает металл от атмосферных воздействий, обеспечивая высокую коррозионную устойчивость. Химические свойства алюминия1. Отношение к простым веществам:
2. Взаимодействие со сложными веществами: а) взаимодействие с водой
Наблюдайте выделение водорода и образование студенистого осадка гидроксида алюминия. Когда наберется достаточно много осадка, извлеките проволоку из воды, обсушите фильтровальной бумагой и положите на подставку. Через несколько минут рассмотрите образовавшийся на поверхности алюминия оксид. Зарисуйте алюминиевую проволоку до опыта и после него. Сущность процессов выражается уравнениями: 2Аl + 6Н2O = 2Аl(ОН)3 + ЗН2↑
Сr2О3 + 2Аl = 2Сr + Аl2O3
в) взаимодействие с кислотами и щелочами
Алюминий реагирует с соляной и разбавленной серной кислотами:
2Аl + 3H2SO4 = Al2(SO4)3 + ЗН2↑
но не взаимодействует при нормальных условиях с очень разбавленными и концентрированными растворами азотной кислоты (пассивируется).
После удаления оксидной пленки алюминий активно взаимодействует со щелочами, образуя комплексные соединения (гексагидроксоалюминаты). Сущность процесса взаимодействия алюминия со щелочью можно выразить следующим уравнением реакции:
|
|
|



 Что вам известно о физических свойствах алюминия и его применении?
Что вам известно о физических свойствах алюминия и его применении?

 Лабораторный опыт. Изучение свойств алюминия. Рассмотрите образцы алюминиевой фольги и проволоки. Несколько раз согните и разогните проволоку. О каком свойстве алюминия позволяют судить эти действия? Поцарапайте поверхностную оксидную пленку на проволоке. Что вы наблюдаете?
Лабораторный опыт. Изучение свойств алюминия. Рассмотрите образцы алюминиевой фольги и проволоки. Несколько раз согните и разогните проволоку. О каком свойстве алюминия позволяют судить эти действия? Поцарапайте поверхностную оксидную пленку на проволоке. Что вы наблюдаете?
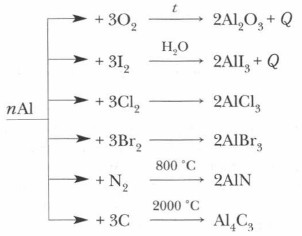
 б) взаимодействие с оксидами металлов — алюмотермия (алюминотермия) Вследствие высокого сродства алюминия к кислороду этот металл способен восстанавливать многие другие металлы (вольфрам, ванадий, хром) из их соединений:
б) взаимодействие с оксидами металлов — алюмотермия (алюминотермия) Вследствие высокого сродства алюминия к кислороду этот металл способен восстанавливать многие другие металлы (вольфрам, ванадий, хром) из их соединений: