|
|
|
|
|
Дополнительный материал к § 52 Роль металлов IIA-группы в живой природе
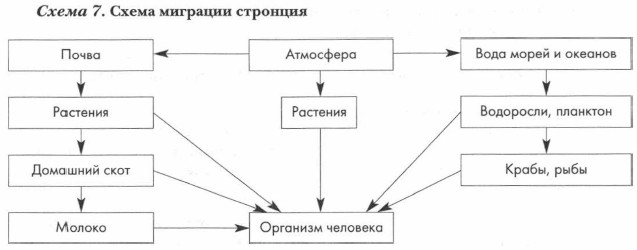
Описание биологических функций элементов главной подгруппы второй группы — трудная задача ввиду множественности этих функций. Поэтому пока ограничимся лишь некоторыми особенно значимыми фактами, которые помогут вам оценить важность изучаемых металлов для живой природы, но, к сожалению, не создадут достаточно полной картины, отражающей их истинное значение для жизни на Земле. Кальций и магний — важнейшие биогенные элементы. Они входят в состав любого живого организма, но роли выполняют, естественно, различные. Магний принимает самое активное участие в фотосинтезе, каждая молекула хлорофилла содержит атом магния. Его массовая доля в пигменте, окрашивающем растения в зеленый цвет, составляет 2%. Магний содержится в крови человека, он необходим для нормальной сердечно-сосудистой деятельности. Медиками установлено, что недостаток этого элемента в организме повышает предрасположенность к инфарктам. При переутомлении у человека наблюдается заметное снижение содержания магния в крови. Значит, для поддержания работоспособности и здоровья важно поддерживать запасы магния в организме. Делать это легко: в картофеле, помидорах, капусте, персиках и абрикосах содержится значительное количество этого элемента. Биологическая роль кальция известна: его фосфаты входят в состав костной ткани всех позвоночных организмов, придавая ей прочность и твердость. Суточная норма потребления кальция человеком — 0,7 г. Многие беспозвоночные организмы (моллюски, иглокожие, членистоногие) используют соединения кальция для строительства наружных скелетов и панцирей. Кальций и стронций схожи по многим свойствам. В частности, стронций (как аналог кальция) способен активно участвовать в обмене веществ живых организмов и откладываться в костной ткани, замещая кальций. Это имеет опасные последствия: в результате осуществляемых на Земле ядерных реакций (например, во время испытания ядерного оружия) образуется более 200 радиоактивных изотопов различных химических элементов. Большая их часть — короткоживущие. А вот изотоп стронция-90 имеет период полураспада 27,7 года. Атомы этого изотопа активно действуют на все живое: в первую очередь они накапливаются в костной ткани. Результаты такого накопления очень страшны. Организм начинает подвергаться длительному радиоактивному воздействию, под влиянием которого развиваются раковые опухоли, разрушаются кроветворные органы. Стабильные изотопы стронция постоянно присутствуют в живых организмах, не принося им вреда (схема 7). Некоторые из обитателей морей аккумулируют в себе атомы стронция. Известен вид радиолярий (планктонных морских организмов), скелет которых полностью строится из сульфата стронция. Минерал целестин, по всей видимости, представляет собой окаменевшие скопления таких радиолярий. Бериллий и барий не имеют столь значительного распространения в живой природе. Их соединения ядовиты для человека.
|
|
|



 Почему мел и известняк называют осадочными породами?
Почему мел и известняк называют осадочными породами?