|
|
|
|
|
Глава 9. Металлы главных и побочных подгрупп Металлы, принадлежащие к d-элементам. Железо и его важнейшие соединенияГидроксиды железа
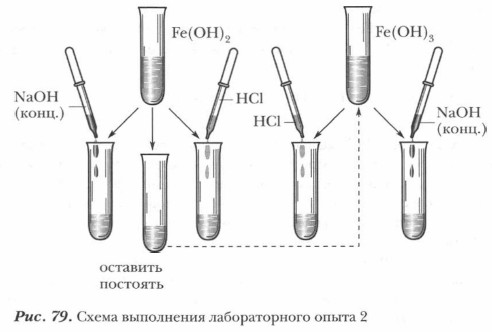
Опыт 1. Получите гидроксиды железа (II) и (III) из растворов соответствующих солей. Для этого к растворам солей Fe2+, Fe3+ прилейте раствор щелочи. Сравните полученные осадки по внешнем)7 виду. Опыт 2. Исследуйте свойства полученных соединений в соответствии со схемой, представленной на рисунке 79. Перед началом работы определите цель каждого опыта.
По всей видимости, за то время, которое вы затратили на выполнение опытов, цвет гидроксида железа(II) изменился: сначала он приобрел зеленоватый оттенок, затем зеленая окраска усилилась и постепенно перешла в бурую. Это объясняется тем, что гидроксид железа (II) на воздухе быстро окисляется в соответствии с уравнением реакции: 4Fe(OH)2 + 2Н2O + O2 = 4Fe(OH)3 Гидроксид железа(II) легко вступает во взаимодействие с минеральными кислотами, образуя соли: Fe(OH)2 + 2НСl = FeCl2 + 2Н2O
Гидроксид железа (II) не взаимодействует с растворами щелочей. Он представляет собой нерастворимое основание. Красно-бурый гидроксид железа (III) — еще более слабое основание. Он взаимодействует с кислотами и с концентрированными растворами щелочей, проявляя слабые амфотерные свойства и образуя комплексные соединения (гидроксокомплексы), аналогичные гидроксокомплексам алюминия:
Здесь Fe2+ — восстановитель.
Реактивом на ионы Fe2+ служит гексацианоферрат(III) калия, или красная кровяная соль K3[Fe(CN)6], При их взаимодействии выпадает темно-синий осадок турнбулевой сини:
Среди солей железа (III) выделим несколько наиболее широко употребляемых. Хлорид железа (III) FeCl3 — очень гигроскопичное темно-коричневое кристаллическое вещество, расплывающееся на воздухе, легко превращается в буро-оранжевые кристаллогидраты, содержащие различное количество воды. Он применяется при очистке воды, для протравливания тканей при их окрашивании. Протравливание осуществляют с целью более прочного закрепления краски на поверхности ткани.
Сульфат железа (III) Fe2(SO4)3 — очень гигроскопичные, расплывающиеся на воздухе кристаллы, как и FeCl3, применяется при очистке воды, а также для травления металлов. Для соединений Fe3+ характерны окислительно-восстановительные реакции, в которых они выступают в роли окислителей.
Для обнаружения ионов Fe3+ используют несколько реактивов. Одним из наиболее чувствительных, позволяющих обнаружить даже следы, является роданид калия или аммония (KCNS или NH4CNS), дающий с ионом Fe3+ кроваво-красный тиоцианат железа Fe(CNS)3:
FeCl3 + 3KCNS = Fe(CNS)3 + ЗКСl
Применяют для этого также желтую кровяную соль — гексацианоферрат(II) калия K4[Fe(CN)6], при этом образуется синий осадок берлинской лазури:
Основные понятия d-Элементы • Оксиды железа • Гидроксиды железа • Соли железа • Железные руды • Свойства железа • Красная кровяная соль • Турнбулева синь • Желтая кровяная соль Вопросы и задания
|
|
|



 Лабораторный опыты. Получение гидроксидов железа и изучение их свойств.
Лабораторный опыты. Получение гидроксидов железа и изучение их свойств.
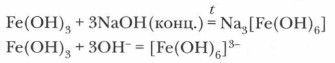
 Соли железа. При взаимодействии железа с растворами кислот образуются соли железа(II). Как и Fe(OH)2, они неустойчивы и легко окисляются. При стоянии на воздухе их растворы изменяют окраску из-за частичного окисления железа сначала с серой на зеленоватую, а затем на бурую:
Соли железа. При взаимодействии железа с растворами кислот образуются соли железа(II). Как и Fe(OH)2, они неустойчивы и легко окисляются. При стоянии на воздухе их растворы изменяют окраску из-за частичного окисления железа сначала с серой на зеленоватую, а затем на бурую:
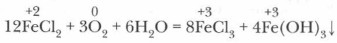
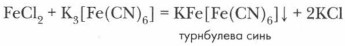
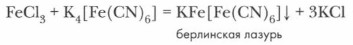
 1. Охарактеризуйте распространение железа в природе.
1. Охарактеризуйте распространение железа в природе.
 2. Дайте сравнительную характеристику свойств оксидов железа.
2. Дайте сравнительную характеристику свойств оксидов железа.
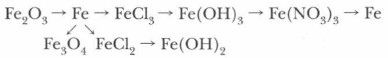
 5. Составьте сравнительную таблицу «Железо — химический элемент и простое вещество».
5. Составьте сравнительную таблицу «Железо — химический элемент и простое вещество».