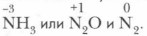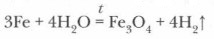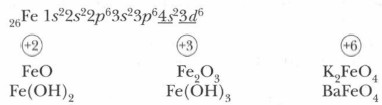|
|
|
|
|
Глава 9. Металлы главных и побочных подгрупп § 54. Металлы, принадлежащие к d-элементам. Железо и его важнейшие соединения
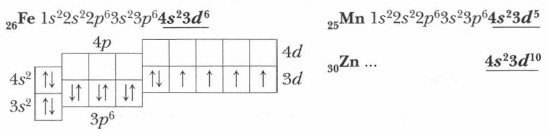
Для элементов побочных подгрупп характерна общая особенность: электроны заполняют в их атомах не внешний, а предвнешний подуровень энергетического уровня. Например, в атомах железа (элемента № 26) после заполнения 4s-подуровня очередной электрон помещается не на внешний 4p-подуровень — четвертый энергетический уровень электронной оболочки, а на третий — предвнешний, на свободную d-орбиталь:
На внешнем уровне у d-элементов, как правило, сохраняется два s-электрона. Все d-элементы проявляют металлические свойства. Валентными в их атомах являются энергетически близкие s- и р-орбитали внешнего и d-орбитали предвнешнего энергетических уровней. Это обусловливает следующие особенности d-элементов. 1. В периодической системе d-элементы располагаются между s- и p-элементами, являясь элементами побочных подгрупп. 2. d-Элементы проявляют металлические свойства, а образуемые ими простые вещества — металлы. 3. Большинство d-элементов проявляет переменные степени окисления и образует несколько рядов соединений, различных по кислотно-основным свойствам. 4. В побочных подгруппах (в отличие от главных подгрупп) химическая активность металлов уменьшается с увеличением порядкового номера. 5. С увеличением значения степени окисления металла происходит ослабление основных и усиление кислотных свойств у образуемых ими оксидов и гидроксидов. Металлы, образованные d-элементами, многочисленны и разнообразны по свойствам. Многие из них (хром, титан, цинк, медь) находят широкое применение и составляют незаменимую основу современной техники. Железо как химический элемент и простое вещество
Железо на Земле встречается повсеместно, на его долю приходится 4,5% атомов земной коры. Оно есть почти во всех глинах, песках, горных рудах. В некоторых местах оно образует мощные скопления руд. Организм взрослого человека содержит около 3 г железа. Но все это — в связанном виде. Чистое железо на Земле имеет преимущественно метеоритное происхождение (на поверхность нашей планеты ежегодно падает до 3000 т метеоритного вещества).
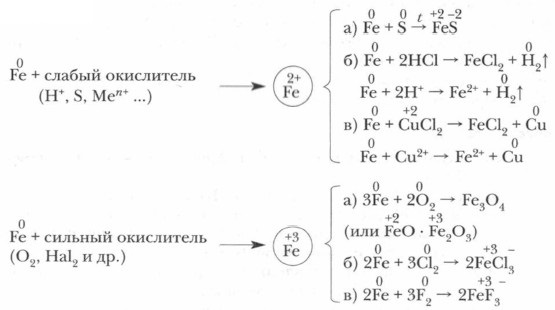
Ценные качества железа побудили человека еще во II тысячелетии до н. э. направить огромные усилия на нахождение способов его получения (восстановления) из руд. Важнейшие железные руды: магнитный железняк (магнетит) Fe3O4 (Fe2O3FeO); красный железняк (гематит) Fe2O3; бурый железняк (лимонит) Fe2O3 • Н2O; пирит FeS2. Физические свойства железа. Железо — блестящий серебристо-белый, легко намагничивающийся и размагничивающийся металл. Оно обладает рядом ценных качеств: пластичностью, способностью легко коваться как в холодном, так и в нагретом состоянии, поддается волочению, прокатке и штамповке. Температура его плавления 1539 °С, температура кипения 3200 °С. Способность железа растворять углерод и другие вещества служит основой для получения многочисленных железных сплавов. Химические свойства железа. Железо легко вступает во взаимодействие со многими веществами.
Как видно из приведенных примеров, степень окисления железа в продуктах реакций зависит от силы окислителя, с которым оно вступает во взаимодействие. При высокой температуре (700-900 °С) железо реагирует с парами воды:
Важнейшие соединения железа. В соединениях железо проявляет следующие степени окисления: +2, +3 и реже +6:
Оксиды железа. Оксид железа (II) — порошок черного цвета. Его получают, нагревая оксид железа (III) в атмосфере угарного газа:
Солеобразующий оксид железа (III) — порошок коричневого цвета, самое устойчивое кислородсодержащее соединение железа. Он применяется в качестве прочной и устойчивой к свету краски, называемой железным суриком. Сурик как универсальный краситель используется для окрашивания вагонов, локомотивов, цемента, почтового сургуча. Издавна на его основе приготавливают художественные краски. Солеобразующий оксид железа Fe3O4(Fe2O3 • FeO) получается при сгорании железа в атмосфере (избытке) кислорода.
|
|
|



 На основании каких общих признаков строения атомов элементы вставных декад больших периодов могут быть объединены в одну группу?
На основании каких общих признаков строения атомов элементы вставных декад больших периодов могут быть объединены в одну группу?
 В истории развития человечества принято выделять три эпохи: каменный, бронзовый и железный века. Термин «железный век» введен в науку в середине XIX в. датским ученым, археологом К.Ю. Томсеном. Для этого периода определены следующие временные границы: от IX—VIII вв. до н. э. и по сегодняшний день.
В истории развития человечества принято выделять три эпохи: каменный, бронзовый и железный века. Термин «железный век» введен в науку в середине XIX в. датским ученым, археологом К.Ю. Томсеном. Для этого периода определены следующие временные границы: от IX—VIII вв. до н. э. и по сегодняшний день.