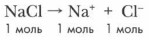|
|
|
|
|
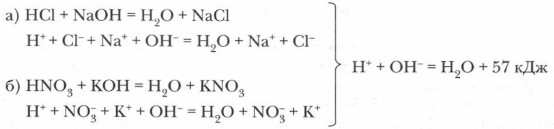
Дополнительный материал к § 4—6 Из истории создания и развития теории электролитической диссоциацииНа протяжении всей истории развития химических знаний растворы постоянно были предметом изучения. Способность растворов многих веществ проводить электрический ток была открыта М. Фарадеем в начале XIX в. Гипотезы о диссоциации веществ на ионы высказывались К. Гротгусом (1805), А.У. Уильямсоном (1851), Р. Клаузиусом (1857), Г. Гельмгольцем (1 882). Однако все они ограничивались лишь предположением, не давая развернутых доказательств этой идеи. Например, немецкий физик Гельмгольц полагал, что все электролиты в растворах полностью распадаются на ионы. Однако эта гипотеза не объясняла, например, факта увеличения электропроводности растворов по мере их разбавления, как и многих других фактов, обнаруженных в экспериментальных исследованиях. К 80-м годам XIX в. в науке накопилось много фактов, характеризующих поведение растворов, но не поддающихся объяснению. Например, не удавалось объяснить, почему реакция нейтрализации между разными кислотами и щелочами в тех случаях, когда на 1 моль щелочи приходится 1 моль кислоты, всегда сопровождается одинаковым тепловым эффектом, равным 57 кДж. Было установлено также, что растворы замерзают при более низкой температуре, чем чистые растворители. При этом понижение температуры замерзания всегда пропорционально числу частиц растворенного в единице объема вещества. Так, при растворении в 1000 г растворителя 1 моль вещества температура замерзания должна понижаться на 1,86 °С. Однако при определении температуры замерзания электролитов было обнаружено много несоответствий этим расчетно-экспериментальным данным. Например, раствор хлорида натрия, содержащий 1 моль вещества в 1 000 г растворителя, замерзает не при -1,86 °С, а при -3,36 °С.
Подобных фактов было накоплено немало. Требовалось дать им объяснение на основе новой системы теоретических взглядов. Эту задачу и решил 29-летний шведский исследователь С.А. Аррениус. Многочисленные опыты и наблюдения, проведенные Аррениусом, а также научные результаты, полученные его коллегами (в первую очередь — теория разбавленных растворов Вант-Гоффа), позволили ему сформулировать положения физической теории электролитической диссоциации, согласно которым:
Эти положения объясняли многое, например перечисленные выше непонятные факты. Пример 1. Одинаковое значение теплового эффекта реакций нейтрализации объясняется тем, что сущность всех таких реакций сводится к одному и тому же процессу: связыванию протонов и гидроксид-ионов и образованию молекул воды и, естественно, характеризуется одним и тем же тепловым эффектом:
Пример 2. Понижение точки замерзания растворов электоролитов происходит пропорционально числу частиц, содержащихся в растворе. Так, при диссоциации одного моля хлорида натрия образуются два моля ионов:
Причин диссоциации Аррениус не раскрыл. Теории электролитической диссоциации было суждено пройти путь от полного неприятия большинством ученых до полного признания. Д.И. Менделеев принадлежал к категорическим противникам идей Аррениуса и отстаивал идею образования соединений из молекул растворенного вещества и растворителя, т. е. предполагал, что растворы имеют химическую природу. Химическая, или гидратная, теория растворов противопоставлялась теории Аррениуса (физической). В дальнейшем синтез идей этих двух теорий привел к созданию современной теории растворов. Огромная роль в создании гидратной теории принадлежит представлениям о химической сущности процесса растворения, обоснованным русскими учеными Д.П. Коноваловым, И.А. Каблуковым и В.А. Кистяковским.
|
|
|