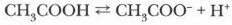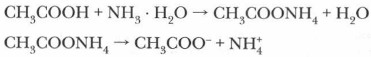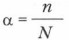|
|
|
|
|
Глава 2. Растворы. Теория электролитической диссоциации § 7. Сильные и слабые электролиты. Количественные характеристики процесса электролитической диссоциацииПроблема. Все ли молекулы электролитов, содержащиеся в растворе, подвергаются диссоциации? Поиск ответа на вопрос начнем с демонстрации опыта.
Оказывается, электролиты по способности диссоциировать на ионы при растворении делятся на сильные и слабые. Их поведение при растворении различно. Часть молекул слабых электролитов под действием растворителя распадается на ионы. Процесс их диссоциации обратим, так как при столкновениях ионы легко ассоциируются (объединяются), поэтому в растворах слабых электролитов устанавливается динамическое равновесие между ионами и недиссо- циированными молекулами:
В растворах слабых электролитов ионов может быть так мало, что для обнаружения электропроводности раствора потребуются чувствительные приборы. При растворении сильных электролитов диссоциация происходит практически полностью, ионные кристаллы или молекулы распадаются с образованием гидратированных (сольватированных) ионов. Химические уравнения, описывающие этот процесс, мы неоднократно составляли: КВr → К+ + Вr- В рассмотренном опыте при соединении растворов слабых электролитов, например аммиака и уксусной кислоты, образуется ацетат аммония — соль, имеющая ионное строение и являющаяся сильным электролитом:
Поскольку в растворах электролитов наряду с ионами присутствуют молекулы, важной их характеристикой является степень диссоциации.
Степень диссоциации обозначается буквой греческого алфавита α (альфа) и измеряется в долях единицы: от 0 (диссоциации нет) до 1 (все молекулы диссоциированы); в процентах: от 0 до 100%. Например, если α = 40%, это означает, что из каждых 100 молекул на ионы распалось 40 (см. схему 1).
|
|
|



 Демонстрационный опыт. Исследование электропроводности растворов. Нальем в химические стаканы концентрированные растворы аммиака и уксусной кислоты и поочередно (не забывая каждый раз промывать их в воде) опустим в жидкости электроды прибора для проверки электропроводности растворов. В обоих случаях лампочка прибора загорается очень слабо или не загорается совсем. Соединим содержимое стаканов и повторим испытание. Лампа ярко вспыхивает, что свидетельствует об электропроводности раствора, а следовательно, о присутствии в нем ионов. Как это объяснить?
Демонстрационный опыт. Исследование электропроводности растворов. Нальем в химические стаканы концентрированные растворы аммиака и уксусной кислоты и поочередно (не забывая каждый раз промывать их в воде) опустим в жидкости электроды прибора для проверки электропроводности растворов. В обоих случаях лампочка прибора загорается очень слабо или не загорается совсем. Соединим содержимое стаканов и повторим испытание. Лампа ярко вспыхивает, что свидетельствует об электропроводности раствора, а следовательно, о присутствии в нем ионов. Как это объяснить?