|
|
|
|
|
Глава 3. Электрический ток в различных средах § 3.4. Электрический ток в растворах и расплавах электролитов
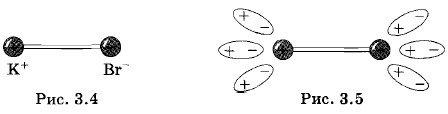
Соединим последовательно источник тока, электрическую лампочку и два электрода (две пластинки). Электроды разъединены (цепь не замкнута), поэтому, естественно, лампочка не горит. Опустим теперь электроды в сосуд с дистиллированной водой. Лампочка также не горит. Значит, дистиллированная вода не является проводником электрического тока. Вынем электроды из воды и поставим их на лист бумаги, на который насыпана поваренная соль NaCl. Лампочка и теперь не горит. Следовательно, и сухая соль не является проводником электрического тока. Наконец, еще раз опустим в дистиллированную воду электроды с прилипшей к ним солью. Мы увидим, что лампочка загорелась, что свидетельствует о появлении электрического тока. Таким образом, хотя в отдельности дистиллированная вода и соль не являются проводниками, раствор соли в воде является хорошим проводником электрического тока. То же можно сказать (и на опыте в этом убедиться) о водных растворах кислот и щелочей. Электролитическая диссоциацияЗаряженные частицы, обеспечивающие электрический ток в этих растворах, образуются в результате электролитической диссоциации. Из-за взаимодействия с полярными молекулами воды молекулы растворяемых веществ распадаются на разноименно заряженные «осколки» — ионы. Положительно заряженными оказываются ионы металлов и водорода, а отрицательно заряженными — кислотные остатки и гидроксильная группа (ОН). Рассмотрим этот процесс подробнее на примере бромида калия КВr. Взаимодействие атомов брома и калия в молекуле бромида калия упрощенно можно представить как взаимодействие двух ионов: положительно заряженного иона К+ и отрицательно заряженного иона Вr-. Объясняется это тем, что единственный валентный электрон у калия слабо связан с атомом. При образовании молекулы КВr этот электрон переходит к атому брома, превращая его в отрицательный ион Вr-. В соответствии с этим молекулу КВr можно схематически изобразить в виде диполя (рис. 3.4). При растворении соли бромида калия в воде молекулы КВr попадают в окружение молекул воды, которые тоже являются диполями. В электрическом поле, создаваемом молекулой КВr, молекулы воды ориентируются, как показано на рисунке 3.5. При этом они растягивают молекулу КВr настолько, что незначительная встряска при столкновении с другими молекулами, участвующими в тепловом движении, разрушает ее. Часть молекул КВr распадается — диссоциирует на ионы К+ и Вr-.
Степень диссоциации, т. е. доля молекул растворенного вещества, которые распадаются на ионы, зависит от температуры, концентрации раствора и диэлектрической проницаемости е растворителя. С увеличением температуры степень диссоциации возрастает и, следовательно, увеличивается концентрация положительно и отрицательно заряженных ионов. Наряду с процессом диссоциации в растворах электролитов происходит и обратный процесс. Ионы разных знаков при встрече могут снова объединиться в нейтральные молекулы — рекомбинировать (воссоединяться). При неизменных условиях в растворе устанавливается динамическое равновесие, при котором число молекул, распадающихся за секунду на ионы, равно числу пар ионов, которые за то же время вновь воссоединяются в нейтральные молекулы. При наступлении динамического равновесия концентрация ионов в растворе электролита сохраняется постоянной (при неизменной температуре).
|
|
|