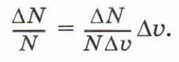|
|
|
|
|
Глава 4. Основы молекулярно-кинетической теории строения вещества Опытное определение скоростей движения молекулРаспределение молекул по скоростям2. В таблице 13 приведено распределение молекул азота по скоростям при комнатной температуре. Из таблицы видно, что наибольшее число молекул имеют скорости, значения которых лежат в интервале от 300 до 500 м/с, 91% молекул имеют скорости, значения которых заключены в интервале от 100 до 700 м/с, и лишь 9% молекул имеют значения скоростей меньше 100 м/с и больше 700 м/с.
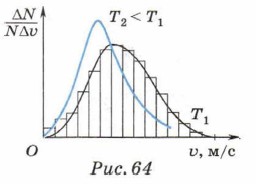
Теоретически закон распределения молекул по скоростям установил английский физик Максвелл в 1859 г., т. е. задолго до опытов Штерна. График распределения молекул по скоростям приведён на рисунке 64. По оси абсцисс отложены значения скоростей молекул; по оси ординат — доля молекул, обладающих скоростями, значения которых лежат в интервале Δυ (0—100, 100—200 м/с и т. д.), отнесенная к ширине интервала скоростей Δυ, т. е.
Доля молекул, значения скоростей которых лежат в интервале от υ до Δυ, численно равна площади прямоугольника, построенного на интервале Δυ как на его стороне:
Построив на каждом интервале скоростей соответствующие прямоугольники, получим распределение молекул по скоростям. Если уменьшить интервалы скоростей, то ломаная линия приблизится к плавной кривой. Значение скорости, которому соответствует максимум кривой, есть наиболее вероятная скорость. При повышении температуры максимум графика смещается в область больших значений скорости, при понижении температуры — в область меньших (см. рис. 64). Таким образом, из опытов по определению скоростей молекул и из теории Максвелла можно сделать следующие выводы. 1. Распределение молекул по скоростям подчиняется определённым закономерностям; оно постоянно во времени при неизменных внешних условиях. 2. Значения скоростей большинства молекул близки к некоторому значению, называемому наиболее вероятным.
Джеймс Клерк Максвелл (1831 —1879) — английский физик, создатель теории электромагнитного поля, член Эдинбургского и Лондонского королевских обществ. Известен своими работами в области молекулярной физики, электродинамики, оптики. Является одним из основателей кинетической теории газов; установил статистический закон распределения молекул по скоростям; обосновал статистический смысл второго начала термодинамики; создал теорию электромагнитного поля, доказал, что свет имеет электромагнитную природу, вычислил давление света. 3. При повышении температуры скорость молекул возрастает, максимум кривой распределения смещается в область больших значений скоростей.
|
|
|




 где N — число молекул в некотором объёме газа, ΔN — число молекул, скорости которых лежат в интервале Δυ.
где N — число молекул в некотором объёме газа, ΔN — число молекул, скорости которых лежат в интервале Δυ.