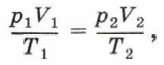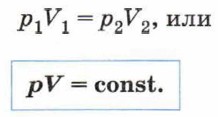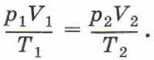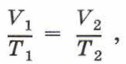|
|
|
|
|
Глава 6. Свойства газов § 31. Газовые законыИзопроцессы1. Состояние идеального газа может изменяться таким образом, что, помимо массы, постоянным будет оставаться один из макроскопических параметров состояния. Например, если внести с улицы в тёплое помещение пустой, плотно закрытый сосуд с жёсткими стенками, то через некоторое время он нагреется. Состояние воздуха в сосуде будет иным, однако его масса и объём останутся прежними, изменятся только давление и температура. В этом и других подобных случаях уравнение состояния можно упростить и, полагая один из макроскопических параметров неизменным, получить связь между двумя параметрами, которые изменяются. Законы, выражающие эту связь, называют газовыми законами. Процессы, протекающие при неизменном значении одного из макроскопических параметров состояния газа, называют изопроцессами (от греч. isos — равный, одинаковый). Изотермический процесс2. Рассмотрим процесс, который происходит при постоянной температуре.
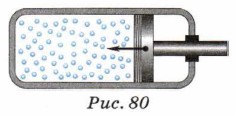
Такой процесс можно осуществить, если медленно сжимать поршнем газ, находящийся в цилиндре (рис. 80). При медленном сжатии теплообмен между газом и окружающим воздухом успевает происходить, и температура газа остаётся неизменной.
Получим уравнение, которым можно описать изменение состояния идеального газа при изотермическом процессе. Для этого запишем уравнение Клапейрона:
где р1 и V1 — давление и объём газа в первом состоянии, р2 и V2 — давление и объём газа во втором состоянии. Учитывая, что Т1 = Т2, получим:
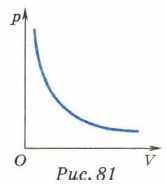
Этот закон назван законом Бойля—Мариотта. Он был независимо установлен английским учёным Робертом Бойлем (1627—1691) в 1662 г. и французским учёным Эдмом Мариоттом (1620—1684) в 1667 г. Графиком зависимости давления газа от его объёма при постоянной температуре — изотермой — является гипербола (рис. 81).
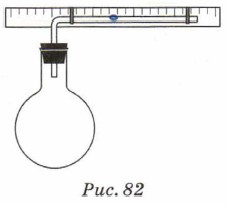
Зависимость давления газа данной массы от его объёма при постоянной температуре можно объяснить на основе молекулярно-кинетической теории строения вещества. Действительно, вам уже известно, что давление газа на стенки сосуда тем больше, чем больше концентрация его молекул. При уменьшении объёма концентрация молекул возрастает, следовательно, увеличивается давление газа; при увеличении объёма концентрация молекул и давление газа увеличиваются. Применим к изотермическому процессу первый закон термодинамики: Q = ΔU + А. Поскольку при изотермическом процессе температура не меняется, то внутренняя энергия остаётся постоянной ΔU = 0, т. е. Q = А или Q = —А'. Это означает, что при изотермическом процессе количество теплоты, переданное системе, идёт на совершение системой работы против внешних сил. При этом, если система получает некоторое количество теплоты, то она расширяется и совершает положительную работу. Если система отдаёт некоторое количество теплоты, то она сжимается и совершает отрицательную работу. Иначе говоря, если газ сжимают изотермически, то он отдаёт некоторое количество теплоты. Закон Бойля—Мариотта применим к идеальному газу, т. е. имеет те же границы применимости, что и модель идеального газа: неприменим при низких температурах и высоких давлениях. Изобарный процесс3. Как и все тела, газы при нагревании расширяются. Продемонстрируем это. Закроем колбу пробкой, в которую вставлена изогнутая под прямым углом стеклянная трубка (рис. 82). В горизонтальной части трубки поместим столбик подкрашенной воды. При нагревании колбы даже руками будет видно, как столбик воды смещается вправо, а при охлаждении — влево. В этом случае меняются температура и объём воздуха в колбе, а давление остаётся постоянным, равным атмосферному.
Установить зависимость объёма газа данной массы от температуры при постоянном давлении можно с помощью описанного выше прибора, если прикрепить к нему шкалу и по ней судить об объёме газа, а температуру измерять термометром. В этом случае зависимость между объёмом и температурой получим экспериментально. Эту же зависимость можно получить теоретически, используя уравнение Клапейрона: Учитывая, что р1 = р2, получим:
или
Этот закон был установлен экспериментально французским физиком Жозефом Луи Гей-Люссаком (1778—1850) в 1802 г. и носит его имя.
|
|
|