|
|
|
|
|
Глава 8. Основы молекулярно-кинетической теории § 53. Основные положения молекулярно-кинетической теории. Размеры молекул (окончание)Количество вещества и постоянная Авогадро. Количество вещества наиболее естественно было бы измерять числом молекул или атомов в теле. Но число молекул в любом макроскопическом теле так велико, что в расчётах используют не абсолютное число молекул, а относительное их число. В Международной системе единиц количество вещества выражают в молях.
Значит, в одном моле любого вещества содержится одно и то же число атомов или молекул.
Для определения постоянной Авогадро надо найти массу одного атома углерода. Приближённая оценка массы может быть произведена так, как это было сделано выше для массы молекулы воды (наиболее точные методы основаны на отклонении пучков ионов электромагнитным полем). Для массы атома углерода измерения дают: mос = 1,995 • 10-26 кг. Постоянную Авогадро NA можно определить, разделив массу углерода, взятого в количестве одного моля, на массу одного атома углерода:
Наименование моль-1 указывает на то, что NA — число атомов в одном моле любого вещества. Если, например, количество вещества ν = 2,5 моль, то число молекул в теле NA = νNA = 1,5 • 1024. Отсюда видно, что
Огромное числовое значение постоянной Авогадро показывает, насколько малы микроскопические масштабы по сравнению с макроскопическими. Тело, обладающее количеством вещества 1 моль, имеет привычные для нас макроскопические размеры и массу порядка нескольких десятков граммов. Молярная масса. Наряду с относительной молекулярной массой Мr в физике и химии широко используют понятие молярная масса.
Согласно такому определению молярная масса вещества равна произведению массы молекулы на постоянную Авогадро: М = m0NA. (8.5) Масса m любого количества вещества равна произведению массы одной молекулы на число молекул в теле: m = m0N. (8.6) Заменив NA и N в формуле (8.4) их выражениями из формул (8.5) и (8.6), получим ν = m/M. (8.7) Именно такое определение количества вещества дано в учебнике химии. Число молекул любого количества вещества массой m и молярной массой М согласно формулам (8.4) и (8.7) равно: N = νNA = NAm/M. (8.8)
Вопросы к параграфу 1. Какие измерения надо произвести, чтобы оценить размеры молекулы оливкового масла? 2. Если бы атом увеличился до размеров макового зёрнышка (0,1 мм), то размеров какого тела при том же увеличении достигло бы зёрнышко? 3. Перечислите известные вам доказательства существования молекул, не упомянутые в тексте. 4. Чему равна относительная молекулярная масса воды? 5. Заполните таблицу. Основные формулы МКТ
§ 53. Основные положения молекулярно-кинетической теории. Размеры молекул (окончание)<<< К началу параграфа Следующая страница >>>
|
|
|



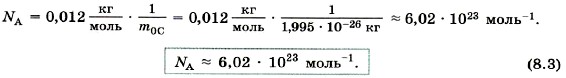
 Подумайте, можно ли по числу молей сравнивать массы двух разных веществ.
Подумайте, можно ли по числу молей сравнивать массы двух разных веществ.
