|
|
|
|
|
Глава 10. Уравнение состояния идеального газа. Газовые законы § 65. Газовые законы (окончание)Изобарный процесс
Согласно уравнению (10.4) в любом состоянии газа с неизменным давлением отношение объёма газа к его температуре остаётся постоянным:
Этот закон был установлен экспериментально в 1802 г. французским учёным Ж. Гей-Люссаком (1778—1850) и носит название закона Гей-Люссака.
Согласно уравнению (10.7) объём газа при постоянном давлении пропорционален температуре: V = const • Т. (10.8)
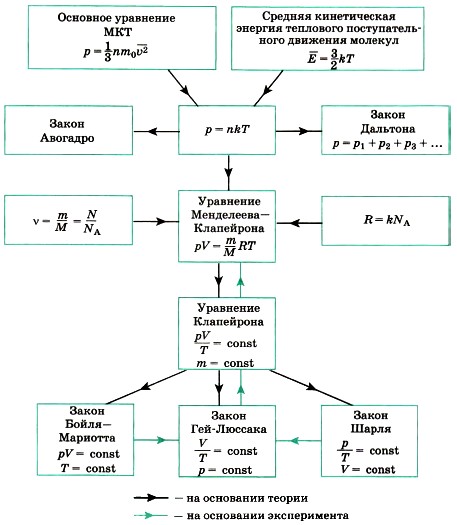
Разным давлениям соответствуют разные изобары (рис. 10.2). Проведём на рисунке произвольную изотерму. С ростом давления объём газа при постоянной температуре согласно закону Бойля— Мариотта уменьшается. Поэтому изобара, соответствующая более высокому давлению р2, лежит ниже изобары, соответствующей более низкому давлению p1. В области низких температур все изобары идеального газа сходятся в точке Т = 0. Но это не означает, что объём реального газа обращается в нуль. Все газы при сильном охлаждении превращаются в жидкости, а к жидкостям уравнение состояния (10.4) неприменимо. Именно поэтому, начиная с некоторого значения температуры, зависимость объёма от температуры проводится на графике штриховой линией. В действительности таких значений температуры и давления у вещества в газообразном состоянии быть не может.
Изобарным можно считать расширение газа при нагревании его в цилиндре с подвижным поршнем, если внешнее давление постоянно. Давление в цилиндре постоянно и равно сумме атмосферного давления и давления mпg/S поршня.
Из уравнения состояния (10.4) вытекает, что в любом состоянии газа с неизменным объёмом отношение давления газа к его температуре остаётся постоянным:
Этот газовый закон был установлен в 1787 г. французским физиком Ж. Шарлем (1746—1823) и носит название закона Шарля.
Согласно уравнению (10.9) давление газа при постоянном объёме пропорционально температуре: р = const • Т. (10.10)
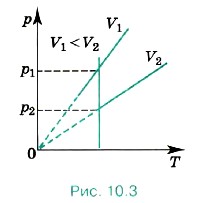
Разным объёмам соответствуют разные изохоры. Также проведём на рисунке произвольную изотерму (рис. 10.3). С ростом объёма газа при постоянной температуре давление его, согласно закону Бойля— Мариотта, падает. Поэтому изохора, соответствующая большему объёму V2, лежит ниже изохоры, соответствующей меньшему объёму V1. В соответствии с уравнением (10.10) все изохоры идеального газа начинаются в точке Т = 0. Значит, давление идеального газа при абсолютном нуле равно нулю. Увеличение давления газа в любом сосуде или в электрической лампочке при нагревании можно считать изохорным процессом. Изохорный процесс используется в газовых термометрах постоянного объёма.
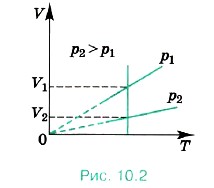
В заключение составим опорную схему (рис. 10.4) и покажем логические переходы, связывающие различные законы и уравнения.
Вопросы к параграфу 1. Вы надули щёки. При этом и объём, и давление воздуха у вас во рту увеличиваются. Как это согласовать с законом Бойля—Мариотта? 2. Как можно осуществить изотермический, изобарный и изохорный процессы? Какое состояние системы (газа) считается равновесным? 3. Как качественно объяснить газовые законы на основе молекулярно-кинетической теории? <<< К началу параграфа Следующая страница >>>
|
|
|



 Слово «изобарный» происходит от греческих слов isos — равный, одинаковый и baros — вес, тяжесть.
Слово «изобарный» происходит от греческих слов isos — равный, одинаковый и baros — вес, тяжесть.

 Начертите изобары в осях р, Т и p, V.
Начертите изобары в осях р, Т и p, V.