|
|
|
|
|
Глава 13. Основы термодинамики § 73. Внутренняя энергияТепловые явления можно описывать с помощью величин (макроскопических параметров), измеряемых такими приборами, как манометр и термометр. Эти приборы не реагируют на воздействие отдельных молекул. Теория тепловых процессов, в которой не учитывается молекулярное строение тел, называется термодинамикой. В термодинамике рассматриваются процессы с точки зрения превращения теплоты в другие виды энергии. Вспомните из курса физики основной школы, что такое внутренняя энергия. Какие способы изменения внутренней энергии вы знаете? Термодинамика была создана в середине XIX в. после открытия закона сохранения энергии. В её основе лежит понятие внутренняя энергия. Само название «внутренняя» предполагает рассмотрение системы как ансамбля движущихся и взаимодействующих молекул. Остановимся на вопросе о том, какая связь существует между термодинамикой и молекулярно-кинетической теорией. Термодинамика и статистическая механика. Первой научной теорией тепловых процессов была не молекулярно-кинетическая теория, а термодинамика.
Сейчас в науке и технике при изучении тепловых явлений используется как термодинамика, так и молекулярно-кинетическая теория. В теоретической физике молекулярно-кинетическую теорию называют статистической механикой.
Главное содержание термодинамики состоит в двух основных её законах, касающихся преобразования энергии. Эти законы установлены опытным путём. Они справедливы для всех веществ независимо от их внутреннего строения. Внутренняя энергия в молекулярно-кинетической теории. Основным понятием в термодинамике является понятие внутренней энергии.
Механическая энергия тела (системы) как целого не входит во внутреннюю энергию. Например, внутренняя энергия газов в двух одинаковых сосудах при равных условиях одинакова независимо от движения сосудов и их расположения относительно друг друга. Вычислить внутреннюю энергию тела (или её изменение), учитывая движение отдельных молекул и их положения относительно друг друга, практически невозможно из-за огромного числа молекул в макроскопических телах. Поэтому необходимо уметь определять значение внутренней энергии (или её изменение) в зависимости от макроскопических параметров, которые можно непосредственно измерить. Внутренняя энергия идеального одноатомного газа. Вычислим внутреннюю энергию идеального одноатомного газа. Согласно модели молекулы идеального газа не взаимодействуют друг с другом, следовательно, потенциальная энергия их взаимодействия равна нулю. Вся внутренняя энергия идеального газа определяется кинетической энергией беспорядочного движения его молекул. Для вычисления внутренней энергии идеального одноатомного газа массой т нужно умножить среднюю кинетическую энергию одного атома на число атомов. Учитывая, что kNA = R, получим формулу для внутренней энергии идеального газа:
Она не зависит от объёма и других макроскопических параметров системы.
Если идеальный газ состоит из более сложных молекул, чем одноатомный, то его внутренняя энергия также пропорциональна абсолютной температуре, но коэффициент пропорциональности между U и Т другой. Объясняется это тем, что сложные молекулы не только движутся поступательно, но ещё и вращаются и колеблются относительно своих положений равновесия. Внутренняя энергия таких газов равна сумме энергий поступательного, вращательного и колебательного движений молекул. Следовательно, внутренняя энергия многоатомного газа больше энергии одноатомного газа при той же температуре.
Зависимость внутренней энергии от макроскопических параметров. Мы установили, что внутренняя энергия идеального газа зависит от одного параметра — температуры. У реальных газов, жидкостей и твёрдых тел средняя потенциальная энергия взаимодействия молекул не равна нулю. Правда, для газов она много меньше средней кинетической энергии молекул, но для твёрдых и жидких тел сравнима с ней. Средняя потенциальная энергия взаимодействия молекул газа зависит от объёма вещества, так как при изменении объёма меняется среднее расстояние между молекулами. Следовательно,
Значения макроскопических параметров (температуры Т, объёма V и др.) однозначно определяют состояние тел. Поэтому они определяют и внутреннюю энергию макроскопических тел. Внутренняя энергия U макроскопических тел однозначно определяется параметрами, характеризующими состояние этих тел: температурой и объёмом.
Вопросы к параграфу 1. Приведите примеры превращения механической энергии во внутреннюю и обратно в технике и быту. 2. От каких физических величин зависит внутренняя энергия тела? 3. Чему равна внутренняя энергия идеального одноатомного газа?
|
|
|



 Термодинамика возникла при изучении оптимальных условий использования теплоты для совершения работы. Это произошло в середине XIX в., задолго до того, как молекулярно-кинетическая теория получила всеобщее признание. Тогда же было доказано, что наряду с механической энергией макроскопические тела обладают ещё и энергией, заключённой внутри самих тел.
Термодинамика возникла при изучении оптимальных условий использования теплоты для совершения работы. Это произошло в середине XIX в., задолго до того, как молекулярно-кинетическая теория получила всеобщее признание. Тогда же было доказано, что наряду с механической энергией макроскопические тела обладают ещё и энергией, заключённой внутри самих тел.

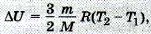
 Выведите выражение (13.1).
Выведите выражение (13.1).