|
|
|
|
|
Глава 13. Основы термодинамики § 78. Первый закон термодинамикиКак формулируется закон сохранения полной механической энергии? При каких условиях внутренняя энергия сохраняется? Первый закон термодинамики — это частный случай закона сохранения энергии, главного закона природы. Он показывает, от каких причин зависит изменение внутренней энергии. Закон сохранения энергии. К середине XIX в. многочисленные опыты доказали, что
Падает, например, молот на кусок свинца, и свинец нагревается. Силы трения тормозят тела, которые при этом разогреваются. На основании множества подобных наблюдений и обобщения опытных фактов был сформулирован закон сохранения энергии.
Закон сохранения энергии управляет всеми явлениями природы и связывает их воедино. Он всегда выполняется абсолютно точно, неизвестно ни одного случая, когда бы этот великий закон не выполнялся. Этот закон был открыт в середине XIX в. немецким учёным, врачом по образованию Р. Майером (1814—1878), английским учёным Дж. Джоулем (1818—1889) и получил наиболее точную формулировку в трудах немецкого учёного Г. Гельмгольца (1821 —1894).
Первый закон термодинамики. Закон сохранения и превращения энергии, распространённый на тепловые явления, носит название первого закона термодинамики. В термодинамике рассматриваются тела, положение центра тяжести которых практически не меняется, т. е. тела, изменение механической энергии которых много меньше изменения их внутренней энергии. Механическая энергия таких тел остаётся постоянной, изменяться может лишь внутренняя энергия каждого тела. До сих пор мы рассматривали процессы, в которых внутренняя энергия системы изменялась либо за счёт совершения работы, либо за счёт теплообмена с окружающими телами. В общем случае при переходе системы из одного состояния в другое внутренняя энергия изменяется одновременно как за счёт совершения работы, так и за счёт передачи теплоты. Первый закон термодинамики формулируется именно для таких общих случаев.
Если система является изолированной, то работа внешних сил равна нулю (А = 0) и система не обменивается теплотой с окружающими телами (Q = 0). В этом случае согласно первому закону термодинамики ΔU = U2 - U1 = 0, или U1 = U2.
Часто вместо работы А внешних тел над системой рассматривают работу А' системы над внешними телами. Учитывая, что А' = -А, первый закон термодинамики (13.11) можно записать так: Q = ΔU + А'. (13.12) Количество теплоты, переданной системе, идёт на изменение её внутренней энергии и на совершение системой работы над внешними телами. Невозможность создания вечного двигателя. Из первого закона термодинамики следует невозможность создания вечного двигателя первого рода, т. е. устройства, способного совершать неограниченную работу без затрат топлива или каких-либо других материалов. Если к системе не поступает тепло (Q = 0), то работа А' согласно уравнению (13.12) может быть совершена только за счёт убыли внутренней энергии: А' = -ΔU. После того как запас энергии окажется исчерпанным, двигатель перестанет работать. Работа и количество теплоты — характеристики процесса изменения внутренней энергии. В данном состоянии система всегда обладает определённой внутренней энергией.
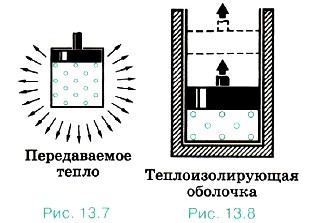
Но нельзя говорить, что в системе содержится определённое количество теплоты или работы. Как работа, так и количество теплоты являются величинами, характеризующими изменение внутренней энергии системы в результате того или иного процесса. Внутренняя энергия системы может измениться на одно и то же значение как за счёт совершения системой работы, так и за счёт передачи окружающим телам какого-либо количества теплоты. Например, нагретый газ в цилиндре может уменьшить свою энергию остывая, без совершения работы (рис. 13.7). Но он может потерять точно такое же количество энергии, поднимая поршень, без отдачи теплоты окружающим телам. Для этого стенки цилиндра и поршень должны быть теплонепроницаемыми (рис. 13.8).
Вопросы к параграфу 1. Как формулируется первый закон термодинамики? 2. В каком случае изменение внутренней энергии отрицательно? 3. Почему можно говорить, что система обладает внутренней энергией, но нельзя сказать, что она обладает запасом определённого количества теплоты или работы? 4. Можно ли считать систему изолированной, если её температура остаётся постоянной? 5. Известно, что при изотермическом процессе идеальный газ совершил работу 2000 Дж. Чему равно количество теплоты, сообщённой системе?
|
|
|



 Как вы понимаете фразу «переход системы из одного состояния в другое»?
Как вы понимаете фразу «переход системы из одного состояния в другое»?
 Систему, которая не обменивается с внешней средой ни энергией, ни веществом, называют изолированной.
Систему, которая не обменивается с внешней средой ни энергией, ни веществом, называют изолированной.