|
|
|
|
|
Глава 13. Основы термодинамики § 79. Применение первого закона термодинамики к различным процессамПеречислите известные вам изопроцессы, происходящие с газом. Как записать первый закон термодинамики для различных процессов? С помощью первого закона термодинамики можно делать важные заключения о характере протекающих процессов. Рассмотрим различные процессы, при которых одна из физических величин, характеризующих состояние газа, остаётся неизменной (изопроцессы). При этом газ будем считать идеальным. Изохорный процесс. При изохорном процессе объём газа не меняется, и поэтому работа газа равна нулю. Изменение внутренней энергии газа согласно уравнению (13.12) равно количеству переданной ему теплоты: ΔU = Q. (13.13) Если газ нагревается, то Q > 0 и ΔU > 0, его внутренняя энергия увеличивается. При охлаждении газа Q < 0 и ΔU = U2 - U1 < 0, изменение внутренней энергии отрицательно и внутренняя энергия газа уменьшается. Для одноатомного газа можно записать: Удельная теплоёмкость газа при изохорном процессе Изотермический процесс. При изотермическом процессе (Т = const) внутренняя энергия идеального газа (см. формулу (13.1)) не меняется. Согласно формуле (13.12) всё переданное газу количество теплоты идёт на совершение работы: Q = А'. (13.14) Если газ получает тепло (Q > 0), то он совершает положительную работу (А' > 0). Если, напротив, газ отдаёт тепло окружающей среде (термостату), то Q < 0 и А' < 0. Работа же внешних сил над газом в последнем случае положительна. Удельная теплоёмкость при изотермическом процессе стремится к бесконечности: сT → ∞.
Изобарный процесс. При изобарном процессе согласно формуле (13.12) передаваемое газу количество теплоты идёт на изменение его внутренней энергии и на совершение им работы при постоянном давлении: Q = ΔU + А' = ΔU + pΔV. Адиабатный процесс. Газ может совершать работу и без сообщения ему теплоты.
Так, если сосуд с газом теплоизолировать от окружающей среды и предоставить возможность газу расширяться, то сила давления газа будет совершать положительную работу. Согласно первому закону термодинамики количество теплоты, сообщенной системе (газу), идёт на изменение внутренней энергии системы и на совершение системой механической работы. В данном случае системе теплота не сообщается и работа равна изменению внутренней энергии, взятому с обратным знаком: А' = -ΔU (Q = 0). Если газ расширяется, то положительная работа совершается газом за счёт уменьшения внутренней энергии: А' > 0, ΔU < 0. Внутренняя энергия газа является функцией температуры, следовательно, изменение температуры газа также отрицательно: ΔТ < 0. При адиабатном расширении газ охлаждается. При сжатии газа, когда внешние силы совершают положительную работу, а соответственно газ — отрицательную, внутренняя энергия газа увеличивается: А' < 0, ΔU > 0. При адиабатном сжатии газ нагревается. Удельная теплоёмкость газа при адиабатном процессе равна нулю, так как Q = 0.
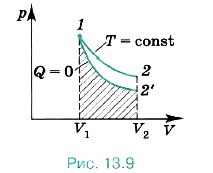
Адиабатный процесс может быть реализован и при отсутствии теплоизоляции. Если процесс расширения или сжатия газа происходит настолько быстро, что за время процесса не успевает произойти теплообмен с внешней средой, то такой процесс также можно считать адиабатным. На рисунке 13.9 показаны процессы расширения газа от объёма V1 до объёма V2 при изотермическом и адиабатном процессах. Мы видим, что начальное состояние газа одно и то же. Так как при адиабатном процессе происходит понижение температуры, то кривая зависимости давления от температуры идёт ниже изотермы. Мы знаем, что работа газа может быть вычислена по площади фигуры, ограниченной графиком зависимости р(V), осью V и отрезками, численно равными давлениям при начальном и конечном состояниях газа. Из рисунка видно, что работа при адиабатном расширении меньше, чем при таком же изотермическом расширении.
Заметим, что адиабата пересекает изотермы, при этом точка пересечения адиабаты с определённой изотермой может быть только одна.
Вопросы к параграфу 1. В каком случае работа газа больше: при изотермическом расширении от объёма V1 до объёма V2 или при изобарном расширении от объёма V1 до объёма F2? 2. Как можно изменить температуру газа? 3. Какой из процессов является самым выгодным для получения максимальной механической работы при данном затраченном количестве теплоты? 4. Почему удельная теплоёмкость при постоянном давлении больше, чем удельная теплоёмкость при постоянном объёме?
|
|
|



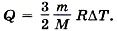
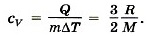
 Выведите выражение для количества теплоты через изменение температуры газа и удельную теплоёмкость газа (р = const).
Выведите выражение для количества теплоты через изменение температуры газа и удельную теплоёмкость газа (р = const).
 Адиабатный процесс вы можете наблюдать, накачивая насосом велосипедную камеру, насос быстро нагревается.
Адиабатный процесс вы можете наблюдать, накачивая насосом велосипедную камеру, насос быстро нагревается.