|
|
|
|
|
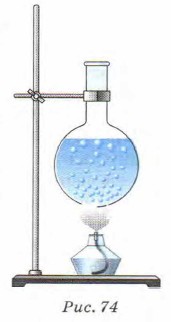
Глава 4. Изменение агрегатных состояний вещества, газов и твёрдых тел § 29. Кипение. Удельная теплота парообразованияКаков механизм конвекции? Каковы условия плавания тел? 1. Рассмотрим процесс перехода жидкости в пар при кипении. Нальём в колбу воду, закрепим её в штативе и начнём нагревать (рис. 74). Будем наблюдать за изменением состояния воды в колбе.
Через некоторое время заметим, что в воде появляются пузырьки. Эти пузырьки содержат воздух и насыщенный водяной пар, который образуется при испарении воды внутрь пузырьков. При повышении температуры растёт давление насыщенного пара в пузырьках и их размеры увеличиваются. Под действием архимедовой силы пузырьки начинают всплывать. Поскольку вода ещё не прогрелась и температура верхних слоёв воды меньше, чем нижних, пар в пузырьках начинает конденсироваться. Их объём уменьшается, пузырьки сжимаются («охлопываются»), и мы слышим шум. Когда вода прогреется по всему объёму, пузырьки с паром уже смогут подняться до поверхности. Достигнув поверхности жидкости, пузырьки лопаются, и пар выходит наружу. Жидкость кипит. Это происходит тогда, когда давление насыщенного пара в них равно атмосферному.
2.
Температура кипения жидкости зависит от атмосферного давления. При повышении атмосферного давления она увеличивается, при понижении — уменьшается. В таблице 17 представлены значения температуры кипения некоторых жидкостей при нормальном атмосферном давлении.
Как видно из данной таблицы, более летучие жидкости — эфир, спирт — кипят при более низкой температуре, чем, например, вода. Это связано с тем, что давление насыщенных паров этих жидкостей уже при комнатной температуре достаточно велико, поскольку их молекулы слабее связаны между собой силами притяжения, чем молекулы других веществ. Давление же паров ртути при комнатной температуре мало. Оно становится равным атмосферному лишь при температуре 357 °С.
|
|
|