|
|
|
|
|
Глава 5. Углеводороды Алкены. Свойства, применение и получениеВ.В. Марковников — ученик А.М. Бутлерова — в 1870 г. сформулировал важное для органической химии правило.
Закономерности подобных реакций В.В. Марковников доказал экспериментально, поэтому они носят название правила Марковникова. Задание. Запишите уравнение химической реакции взаимодействия пропилена с бромоводородом. Дайте название полученному продукту. Д. Полимеризация Проблема. Выскажите свои соображения по поводу того, могут ли молекулы этилена и его гомологи взаимодействовать друг с другом, и подтвердите их фактами. Это схематично можно изобразить так:
Образуется высокомолекулярное вещество.
Сокращённое уравнение реакции полимеризации можно представить следующим образом:
Аналогичный способ краткого написания формулы полимеров применяется и для других полимерных соединений. Продукт реакции полимеризации этилена — полиэтилен (полимер). Исходное вещество (этилен) — мономер, повторяющееся звено (в данном случае —СН2—СН2—) — элементарное, или структурное, звено. Коэффициент n — количество молекул мономера, индекс n — степень полимеризации. Многие полимеры — механически прочные материалы. Они широко используются в промышленности. Изделия из них газо- и влагонепроницаемы, не проводят электрический ток. При обычных условиях на них не действуют органические растворители, они устойчивы к действию концентрированных кислот и щелочей. Позже мы более подробно познакомимся со свойствами этих веществ и механизмом ракции полимеризации (см. с. 261). 2. Реакции окисленияА. Горение. Экзотермическая реакция, протекающая с выделением большого количества теплоты: С2Н4 + 3O2 → 2СО2 + 2Н2O + Q Массовая доля углерода в этилене больше, чем в этане, поэтому этилен горит светящимся пламенем. Смесь этиленовых углеводородов с воздухом взрывоопасна. Б. Окисление перманганатом калия (реакция Вагнера). При мягком окислении этилена и его гомологов происходит разрыв л-связи и малиновая окраска раствора перманганата калия КМпО, исчезает. Эта реакция была открыта в 1888 г. русским химиком Е.Е. Вагнером и носит его имя. Она также является качественной реакцией на алкены. Приводим схему этой реакции (не для запоминания):
При частичном окислении — пропускании смеси этилена с воздухом над серебряным катализатором при нагревании до 350 °С образуется оксид этилена:
Оксид этилена используется для производства различных органических веществ (уксусного альдегида, лаков, пластмасс, волокон, синтетических каучуков и т. д.).
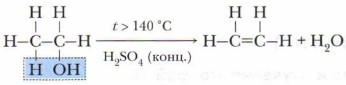
Получение алкенов в лабораторииВ лабораторных условиях этилен получают при нагревании смеси этилового спирта с концентрированной серной кислотой до температуры-140 °С.
От молекулы спирта отщепляется молекула воды. Это реакция отщепления, которая называется реакцией дегидратации. Промышленные способы получения алкенов1. Дегидрирование алканов (реакция отщепления). Это основной источник получения алкенов в промышленности. Процесс проводят при температуре до 450 °С и в присутствии катализатора — оксида хрома(III):
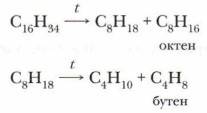
2. Крекинг алканов. При получении алкенов, как правило, используют термический крекинг (температура 400-700 °С) (определение крекинга см. в § 9):
Основные понятия Свойства алкенов • Реакции присоединения • Полимеризация • Реакция Вагнера • Правило Марковникова • Циклоалкены • Крекинг Вопросы и задания
С2Н6 → С2Н5Вr → С2Н4 → (-СН2-СН2-)n
|
|
|




 При повышенной температуре, давлении и в присутствии катализатора молекулы этиленовых углеводородов могут соединяться между собой в длинные цепи за счёт разрыва π-связей.
При повышенной температуре, давлении и в присутствии катализатора молекулы этиленовых углеводородов могут соединяться между собой в длинные цепи за счёт разрыва π-связей.
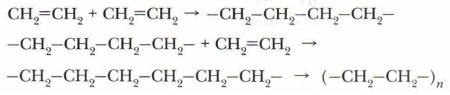
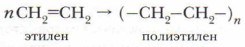
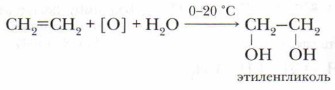
 Демонстрационный опыт. В демонстрационную пробирку с раствором перманганата калия пропустим этилен (см. рис. 25, с. 85). Что вы наблюдаете?
Демонстрационный опыт. В демонстрационную пробирку с раствором перманганата калия пропустим этилен (см. рис. 25, с. 85). Что вы наблюдаете?
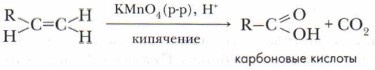
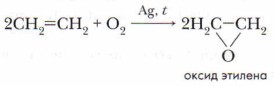
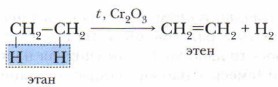
 1. Почему алкены более реакционноспособны, чем алканы?
1. Почему алкены более реакционноспособны, чем алканы?
 2. В двух колбах находятся газы: бутилен и циклобутан. Как распознать эти газы?
2. В двух колбах находятся газы: бутилен и циклобутан. Как распознать эти газы?
 4. Какие изменения происходят в строении молекулы этилена при присоединении к ней молекулы хлора?
4. Какие изменения происходят в строении молекулы этилена при присоединении к ней молекулы хлора?
 5. Используя дополнительную литературу и Интернет, составьте схему применения этилена и дайте к ней пояснения.
5. Используя дополнительную литературу и Интернет, составьте схему применения этилена и дайте к ней пояснения.