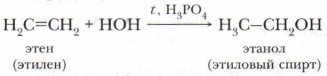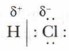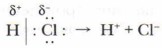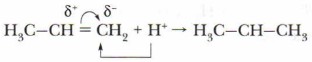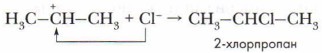|
|
|
|
|
Глава 5. Углеводороды § 12. Алкены. Свойства, применение и получениеКакие углеводороды называются непредельными, ненасыщенными? Объясните, почему они так называются.
Вы уже знакомы со свойствами этилена — первого представителя гомологического ряда алкенов. Теперь у вас есть возможность расширить и углубить свои знания об этом классе углеводородов, опираясь на закономерную связь: строение → свойство → применение и получение. Физические свойства алкеновАлкены по физическим свойствам близки к алканам. В их гомологических рядах наблюдаются те же закономерности в изменениях физических свойств. Первые три члена гомологического ряда алкенов — газы: С2Н4, С3Н6, С4Н8. Углеводороды с числом атомов углерода от С5 до С18 — жидкости, остальные — твёрдые вещества. Как и алканы, они практически нерастворимы в воде. Хорошо растворяются в органических растворителях, таких как бензин, бензол, хлороформ и др. Они легче воды, с увеличением относительной молекулярной массы увеличивается их температура кипения и плавления. Химические свойства алкеновЭтиленовые углеводороды обладают большей химической активностью, чем предельные углеводороды. Проблема. От чего зависит химическая активность алкенов? Какие реакции для них наиболее характерны?
Для алкенов характерны реакции присоединения, при которых ν-связь легко разрывается и к атомам углерода присоединяются другие атомы или группы атомов. Расширим свои знания о свойствах этиленовых углеводородов. 1. Реакции присоединенияА .Гидрирование (гидрогенизация) В присутствии катализатора (Ni, Pt) и при нагревании этиленовые углеводороды взаимодействуют с водородом с образованием предельных углеводородов (алканов):
Задание. Опишите изменения, которые происходят в строении молекулы этилена при присоединении к ней молекулы водорода. Атомы углерода из состояния sр2-гибридизации переходят в состояние sp3-гибридизации. При этом изменяется и пространственное строение молекулы. Из плоской молекулы этилена образуется объёмная молекула этана. Б. Галогенирование
Дихлорэтан — бесцветная летучая жидкость со специфическим запахом, является хорошим растворителем. Токсические свойства дихлорэтана используются в сельском хозяйстве для борьбы с филлоксерой на виноградниках, а также для обеззараживания зернохранилищ.
При пропускании этилена и его гомологов через бромную воду происходит разрыв ν-связи, атомы брома присоединяются к атомам углерода, окраска раствора исчезает. Реакция бромирования является качественной для алкенов и используется для их распознавания. В. Гидрогалогенирование
Хлорэтан — бесцветный газ (при комнатной температуре), при небольшом охлаждении (до 12 °С) превращается в жидкость, испаряясь, поглощает большое количество теплоты. Это свойство используется в медицине при мелких хирургических операциях, когда требуется местная анестезия. Г. Гидратация
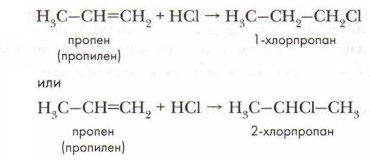
Эта реакция используется для получения этилового спирта в промышленности. Проблема. Мы рассмотрели присоединение сложных веществ (НСl, Н2O) к симметричной молекуле этилена. А почему и как пойдёт реакция присоединения хлороводорода к гомологам этилена несимметричного строения, например к пропилену? Для этого рассмотрим механизм реакции присоединения.
Хлороводород НСl — полярное соединение. Атом водорода имеет частичный положительный заряд, атом хлора — частичный отрицательный заряд:
При сближении молекул хлороводорода и пропена происходит разрыв связи Н—Сl и образуются ионы:
Положительно заряженный ион водорода (протон) — электрофильная частица атакует молекулу алкена, при этом ν-связь поляризуется быстрее σ-связи и разрывается. Электрофил присоединяется к звену СН2, так как здесь скапливается бо́льший отрицательный заряд и образуется органический ион — карбокатион:
Карбокатион часто называют σ-комплексом, поскольку при его образовании формируется новая σ-связь.
К карбокатиону затем присоединяется хлорид-ион и образуется 2-хлорпропан:
Таким образом, механизм реакции присоединения условно слагается из трёх стадий. Вначале разрывается связь Н—Сl с образованием неорганических ионов, затем образуется положительно заряженный органический ион — карбокатион Н3С— +СН—СН3, и наконец — нейтральный продукт реакции СН3— СНСl—CH3. Такой механизм реакции называется электрофильным присоединением. Аналогично происходит присоединение к алкенам молекул воды.
|
|
|



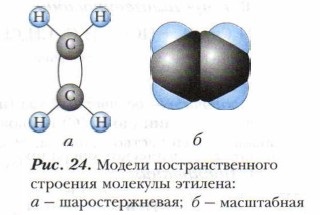
 Если мы рассмотрим пространственное строение алкенов, то увидим, что атомы углерода при двойной связи находятся в sр2-гибридизации и между ними образуется двойная связь, состоящая из ν- и σ-связи (см. § 3). Пространственное расположение атомов в молекуле этилена показано с помощью моделей (рис. 24). Здесь ν-связь менее прочная, чем σ-связь.
Если мы рассмотрим пространственное строение алкенов, то увидим, что атомы углерода при двойной связи находятся в sр2-гибридизации и между ними образуется двойная связь, состоящая из ν- и σ-связи (см. § 3). Пространственное расположение атомов в молекуле этилена показано с помощью моделей (рис. 24). Здесь ν-связь менее прочная, чем σ-связь.
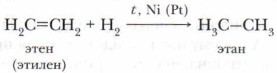
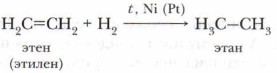
 Демонстрационный опыт. В пробирку с бромной водой пропустим этилен. Что вы наблюдаете? Запишите уравнение проведённой химической реакции. Дайте название полученному веществу.
Демонстрационный опыт. В пробирку с бромной водой пропустим этилен. Что вы наблюдаете? Запишите уравнение проведённой химической реакции. Дайте название полученному веществу.