|
|
|
|
|
Глава 6. Спирты, фенолы § 18. Предельные одноатомные спирты. Гомологический ряд. Состав, строение и физические свойства
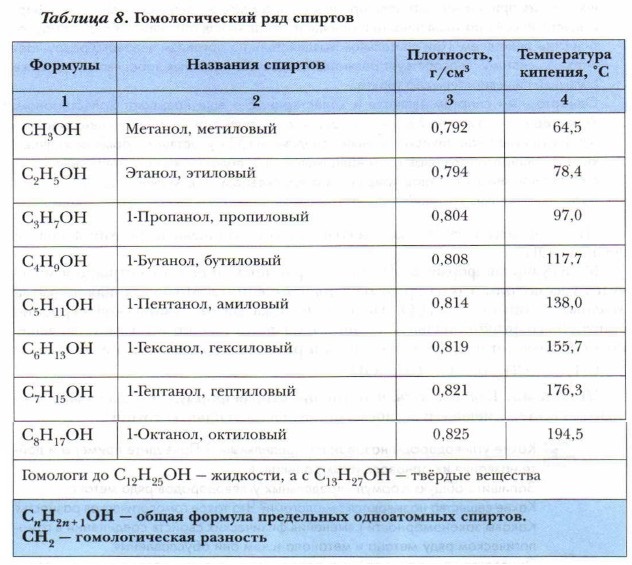
Предельные одноатомные спирты можно рассматривать как производные углеводородов ряда метана, в молекулах которых один атом водорода замещён на гидроксильную группу. Так же как и углеводороды ряда метана, предельные одноатомные спирты образуют гомологический ряд метанола. Составим этот ряд гомологов и рассмотрим закономерности изменения физических свойств соединений этого ряда в зависимости от увеличения уг- леводородного радикала (табл. 8). Важнейшими представителями одноатомных спиртов являются метиловый и этиловый спирты.
Проблема. Что вы знаете о метиловом и этиловом спиртах? Опишите их строение и свойства. Широко используется как растворитель и как исходное сырьё в органическом синтезе. Этиловый спирт С2Н5ОН — этанол — бесцветная горючая жидкость с характерным запахом, tкип = 78,4 °С, смешивается с водой в любых отношениях. В виде ректификата (спирта, очищенного перегонкой) он содержит 95,6 % спирта и 4,4 % воды. Этанол широко применяется как растворитель и как сырьё в органическом синтезе, в фармацевтической промышленности и медицине, а также как горючее. Обладает наркотическим действием. При длительном воздействии на организм человека разрушает нервную систему, способствует развитию сердечно-сосудистых заболеваний, а также болезней пищеварительного тракта.
Одноатомным спиртом является и холестерин. Его ещё называют холестеролом. Холестерин — компонент желчи, играет важную роль в организме, из него синтезируются многие биологически активные соединения. Он участвует в обмене желчных кислот, в синтезе гормонов коры надпочечников и половых желёз. Отложение холестерина на стенках сосудов приводит к атеросклерозу, а в желчном пузыре — к образованию желчных камней. Итак, спирты состоят из углеводородного радикала и функциональной группы —ОН. Молекулярная формула спирта не отражает химического строения молекулы. Рассмотрим это на примере этилового спирта. Молекулярная формула этилового спирта — С2Н60. Но она не показывает химическое строение спирта и его функциональную группу. Этой формуле соответствуют два вещества с разным химическим строением и разными структурными формулами: СН3—O—СН3 и СН3—СН2—ОН Проблема. Как доказать, что именно вторая формула принадлежит этиловому спирту, имеющему в своём составе гидроксильную группу? Для объяснения обратимся к электронному строению молекулы этилового спирта. Его электронная и структурная формулы:
В 9 классе вы уже рассмотрели электронное строение спиртов и выяснили характер и реакционную способность их молекул. Задание. Составьте электронную формулу метилового спирта, указав смещение электронной плотности в молекуле и её наиболее реакционноспособные химические связи.
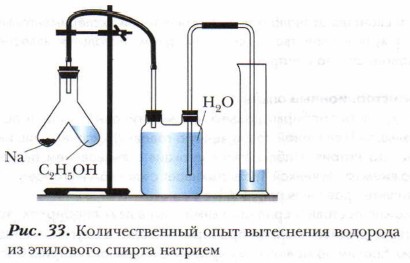
1. В 1/5 часть пробирки нальём чистый этиловый спирт и поместим туда небольшой (величиной со спичечную головку) кусочек очищенного металлического натрия. Наблюдается реакция с выделением бесцветного газа. Подожжём газ лучинкой. Газ вспыхивает с хлопко́м и сгорает — это водород. (Запишите уравнения реакций.) 2. Можно поставить сравнительный опыт в двух пробирках, закреплённых в лапках штатива: в одной пробирке — вода, в другой — спирт. В каждую из них бросим по маленькому кусочку очищенного натрия. Сравним скорости реакций взаимодействия воды и спирта с натрием. Что вы наблюдаете? После окончания реакций в каждую из пробирок добавим по капле раствора фенолфталеина. Что вы наблюдаете? Сделайте выводы. 3. Чтобы доказать, что замещаемый металлом водород принадлежит именно гидроксильной группе, используем количественный опыт. Рассмотрим устройство прибора и то, как связаны между собой его части (рис. 33). Главной частью прибора является реакционный сосуд, представляющий собой пробирку с раздвоением на два колена. В одно колено прибора нальём этиловый спирт, объём которого соответствует массе 2,3 г, что составляет 0,05 моль этого вещества. В другое колено прибора поместим мелкие кусочки натрия (в небольшом избытке). Перельём из первого колена во второе спирт. Наблюдаем бурную реакцию с выделением водорода. Выделяющийся газ вытесняет воду из двугорлого сосуда в мерный цилиндр. Экспериментально устанавливаем, что выделилось 0,56 л водорода. Сделаем расчёты:
На основе данных опыта и расчётов можно сделать вывод: из молекулы спирта натрий вытесняет 1 атом водорода. Если условно принять, что этиловый спирт имеет формулу СН3—О—СН3, то непонятно, почему из шести атомов водорода, входящих в состав метиловых групп, замещаются не шесть равноценных атомов водорода, а лишь один. В формуле СН3—СН2—ОН один атом водорода занимает особое место, находясь в составе группы —ОН. Он не связан непосредственно с атомом углерода, как другие атомы водорода, а связан с атомом кислорода функциональной группы и является наиболее подвижным, легко замещаемым на атомы металла. Отсюда вывод: именно формула СН3— СН2— ОН соответствует этиловому спирту.
|
|
|



 Какие углеводороды называются предельными? Приведите примеры и дайте названия их одновалентных радикалов.
Какие углеводороды называются предельными? Приведите примеры и дайте названия их одновалентных радикалов.
 Метиловый спирт СН3ОН — метанол — бесцветная горючая жидкость со спиртовым запахом, tкип = 64,5 °С, смешивается с водой в любых отношениях, чрезвычайно ядовит. При принятии внутрь даже нескольких капель вызывает тяжёлое отравление, потерю зрения, возможен смертельный исход.
Метиловый спирт СН3ОН — метанол — бесцветная горючая жидкость со спиртовым запахом, tкип = 64,5 °С, смешивается с водой в любых отношениях, чрезвычайно ядовит. При принятии внутрь даже нескольких капель вызывает тяжёлое отравление, потерю зрения, возможен смертельный исход.

 Демонстрационные опыты
Демонстрационные опыты