|
|
|
|
|
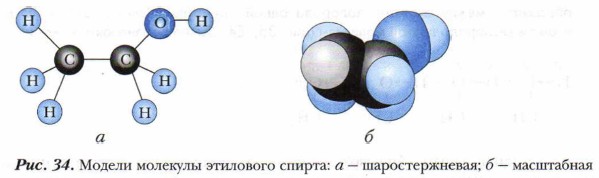
Глава 6. Спирты, фенолы Предельные одноатомные спирты. Гомологический ряд. Состав, строение и физические свойстваХимическое строение предельных одноатомных спиртов передают и их модели. На рисунке 34 представлены разные модели молекулы этилового спирта.
Наиболее реакционноспособной частью молекулы спирта является его функциональная группа, а в ней — химическая связь —О—Н. Проблема. Почему самый подвижный атом в молекуле спирта — атом водорода гидроксильной группы? Приведите доказательства. Являясь производными углеводородов, спирты имеют с ними как сходные свойства, так и существенные различия. Обратимся к таблицам гомологических рядов предельных углеводородов (см. табл. 6) и предельных одноатомных спиртов (см. табл. 8). Задание. Сопоставьте гомологический ряд метана с гомологическим рядом предельных одноатомных спиртов. Сравните их агрегатные состояния, плотность и температуры кипения. На основании проведённого сравнения можно сделать вывод, что и у спиртов, и у углеводородов наблюдается общая закономерность; с увеличением молекулярной массы температура кипения и плотность увеличиваются. Однако у спиртов более высокая температура кипения, чем у углеводородов с тем же числом атомов углерода. Проблема. Как объяснить, что первые представители гомологического ряда углеводородов — вещества газообразные, а метанол и этанол — первые гомологи в ряду спиртов — жидкости? Молекулы воды и спиртов имеют угловую форму.
Вывод: строение спиртов обусловливает их физические свойства: агрегатное состояние, температуру кипения, плотность, растворимость в воде. Проблема. Чем объяснить, что вода, вещество с меньшей молекулярной массой, чем у метилового и этилового спиртов, имеет более высокую температуру кипения по сравнению со спиртами?
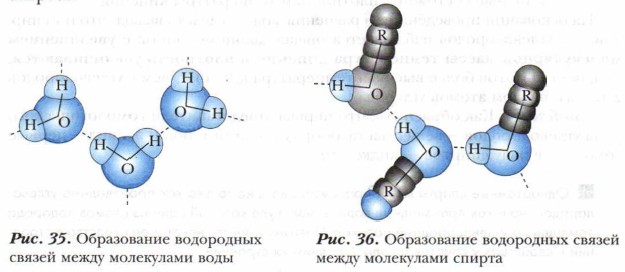
Водородные связи образуются как между молекулами воды, так и между молекулами спиртов, точнее, между атомами водорода и атомами кислорода молекул (рис. 36). Водородная связь оказывает большое влияние на физические свойства спиртов.
Водородные связи могут возникать между молекулами разных полярных соединений, например между молекулами спирта (растворяемое вещество) и молекулами воды (растворителем). Это обеспечивает их хорошую растворимость друг в друге, что подтверждает правило «подобное растворяется в подобном» (рис. 37).
Если углеводородный радикал в молекуле спирта небольшой, то водородные связи между молекулами спирта и воды устанавливаются легко, растворимость спирта в воде (например, метанола и этанола) является неограниченной. С увеличением углеводородного радикала уменьшается суммарное число водородных связей, вследствие чего растворимость спиртов в воде уменьшается. Выводы 1. Предельные одноатомные спирты отличаются друг от друга по составу на гомологическую разность —СН2—. Общая формула спиртов R—ОН. 2. Состав и строение углеводородного радикала влияет на физические свойства одноатомных спиртов. С увеличением числа атомов углерода в радикале и молекулярной массы спиртов повышается их температура кипения, плотность, изменяется их агрегатное состояние (спирты с числом атомов углерода С1-12 — бесцветные жидкости, С13-20 — вязкие, сиропообразные вещества, С21 и выше — твёрдые вещества). 3. Спирты растворимы в воде. Растворимость спиртов в воде различная. Первые три гомолога (метиловый, этиловый и пропиловый спирты) смешиваются с водой в любых отношениях. По мере увеличения Мr спиртов их растворимость быстро уменьшается. 4. Спирты обладают запахом: метиловый и этиловый имеют специфический алкогольный запах, другие жидкие спирты — удушливый неприятный, но есть спирты с приятным запахом розы, жасмина и др. 5. Предельным одноатомным спиртам присуща изомерия: а) углеводородного скелета; б) положения функциональной группы —ОН. Основные понятия Предельные одноатомные спирты • Классификация • Изомерия • Номенклатура • Гомологический ряд • Общая формула гомологов • Строение молекулы спирта • Водородная связь Вопросы и задания
|
|
|



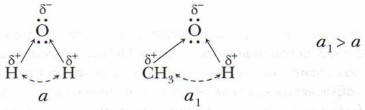
 Одноатомные спирты можно рассматривать не только как производные углеводородов, но и как производные воды, в молекуле которой один из атомов водорода замещён на углеводородный радикал. Поэтому имеется некоторое сходство в строении и свойствах у спиртов и воды. Сравним их строение.
Одноатомные спирты можно рассматривать не только как производные углеводородов, но и как производные воды, в молекуле которой один из атомов водорода замещён на углеводородный радикал. Поэтому имеется некоторое сходство в строении и свойствах у спиртов и воды. Сравним их строение.
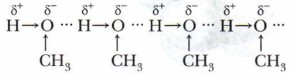
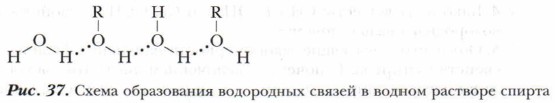
 1. Почему гидроксильная группа спирта называется функциональной?
1. Почему гидроксильная группа спирта называется функциональной?
 3. Объясните подвижность атомов водорода гидроксильной группы спирта и высокую реакционную способность его молекулы.
3. Объясните подвижность атомов водорода гидроксильной группы спирта и высокую реакционную способность его молекулы.
 4. Какому из веществ: СН3СН2ОН или СН3ОСН3 — свойственна водородная связь и почему?
4. Какому из веществ: СН3СН2ОН или СН3ОСН3 — свойственна водородная связь и почему?