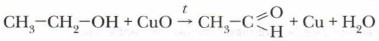|
|
|
|
|
Глава 6. Спирты, фенолы § 19. Химические свойства одноатомных спиртов
При рассмотрении химических свойств одноатомных спиртов мы сначала изучим свойства, присущие всем органическим соединениям, затем — характерные для класса предельных одноатомных спиртов, а после рассмотрим индивидуальные свойства некоторых его представителей. 1. Общее свойство практически всех органических соединений — реакция горения. Как и все органические соединения, спирты горючи. Горение спиртов — экзотермический окислительно-восстановительный процесс. Например: С2Н5ОН + 3O2 → 2СO2 + ЗН2O + 1366 кДж
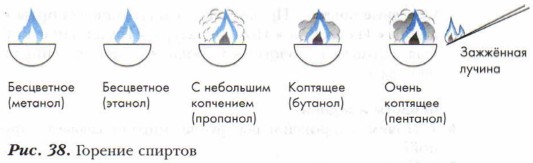
Метанол и этанол легко воспламеняются и горят голубоватым пламенем, спирты с большей молекулярной массой горят светящимся пламенем и даже коптят. Проблема. Почему по мере увеличения молекулярной массы спиртов усиливается их способность коптить при горении? 2. Специфические свойства спиртов. Главные специфические свойства спиртов обусловлены их функциональной группой. Эти свойства вызваны в основном наличием в молекулах спиртов и особенно в группе —ОН полярных связей: Рассмотрим основные химические свойства спиртов на примере этанола (табл. 9).
В свою очередь группа —ОН влияет на углеводородный радикал, уменьшая электронную плотность σ-связей соседнего атома углерода радикала, притягивая её к себе и вызывая отрицательный индуктивный эффект.
Если реакцию дегидратации спирта проводить при более низкой температуре (ниже 1 40 °С), молекулы воды отщепляются уже не от одной молекулы спирта, а от двух, и основным продуктом такой реакции будет простой эфир. В приведённом выше примере продуктом реакции является диэтиловый эфир.
Простые эфиры рассматривают как производные спиртов, у которых атом водорода гидроксильной группы замещён на углеводородный радикал. Их состав выражают формулой R—О—R.
Вам хорошо знаком диэтиловый эфир С2Н5—О—С2Н5. Его применяют в медицине: в зубоврачебной практике используют в качестве средства, осушающего полость рта. Диэтиловый эфир — хороший растворитель жиров, смол, воска и других неполярных органических соединений, легко воспламеняется, поэтому работать с ним нужно осторожно. При каталитическом окислении спиртов образуются альдегиды, следовательно, эту реакцию можно рассматривать и как один из способов получения альдегидов. Используя это химическое свойство спиртов, мы получим из этилового спирта важный продукт — уксусный альдегид.
В этой реакции окисления роль катализатора играет медь. Каталитическое окисление спиртов используется в качестве промышленного способа получения альдегидов. Этот процесс идёт и в организме человека в случае попадания в него спирта. Спирты вступают в реакции и с веществами других классов органических соединений, но об этом вы узнаете немного позже.
|
|
|



 В какие реакции вступают предельные углеводороды? На примере этана запишите уравнения химических реакции и укажите условия их протекания.
В какие реакции вступают предельные углеводороды? На примере этана запишите уравнения химических реакции и укажите условия их протекания.
 Демонстрационный опыт. В четыре фарфоровые чашечки нальём немного метанола, этанола, пропанола и бутанола. С помощью лучинки подожжём спирты. Все они загораются (рис. 38).
Демонстрационный опыт. В четыре фарфоровые чашечки нальём немного метанола, этанола, пропанола и бутанола. С помощью лучинки подожжём спирты. Все они загораются (рис. 38).
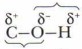
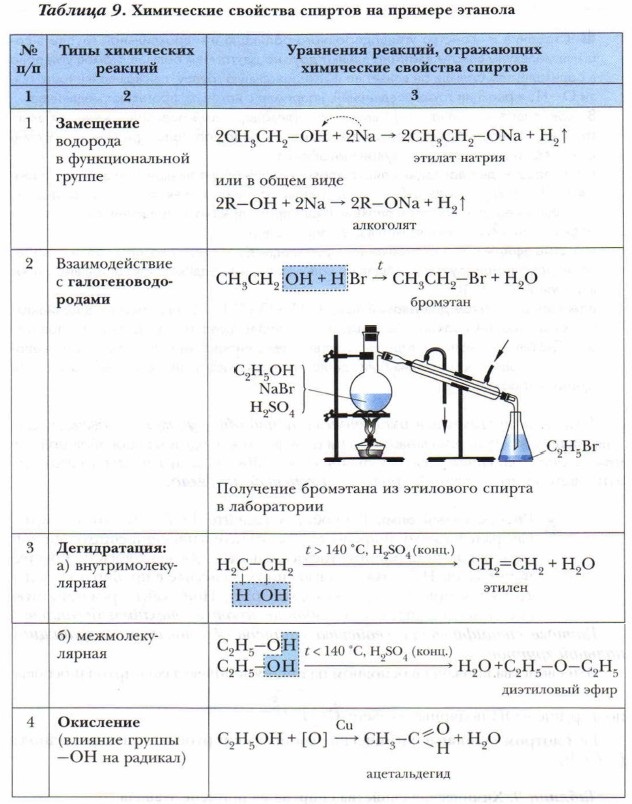
 Строение и свойства углеводородного радикала и гидроксильной группы в составе молекулы спирта взаимно влияют друг на друга. Чем больше атомов углерода в радикале, тем больше он влияет на функциональную группу, снижая полярность связи О—Н, и реакции таких соединений, например с натрием, протекают медленнее.
Строение и свойства углеводородного радикала и гидроксильной группы в составе молекулы спирта взаимно влияют друг на друга. Чем больше атомов углерода в радикале, тем больше он влияет на функциональную группу, снижая полярность связи О—Н, и реакции таких соединений, например с натрием, протекают медленнее.