|
|
|
|
|
Глава 11. Аминокислоты. Пептиды. Белки. Нуклеиновые кислоты АминокислотыХимические свойства аминокислотПроблема. Учитывая особенности состава и строения аминокислот, попытайтесь предсказать их химические свойства. Двойственность химических свойств аминокислот проявляется, в частности, в их способности взаимодействовать с кислотами и с основаниями, т. е. в амфотерности. 1. Проявляя кислотные свойства, аминокислоты вступают в реакции со щелочами с образованием солей:
Проявляя осно́вные свойства, реагируют с кислотами, образуя соли:
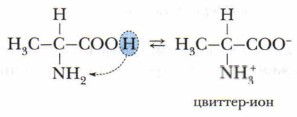
то раствор аминокислоты имеет нейтральный характер. При этом действие одной функциональной группы нейтрализуется противоположным действием второй группы. Отщепление протона от карбоксильной группы при диссоциации аминокислоты и присоединейие протона аминогруппой приводит к образованию биполярного иона (цвиттер-иона).
2. Взаимодействие молекул аминокислот друг с другом (реакция конденсации).
При этом в такой реакции могут участвовать аминокислоты как одинаковые, так и различные. Поскольку в реакции образуются биополимеры (пептиды и белки) и низкомолекулярный продукт (вода), её относят к реакции поликонденсации. Схема реакции следующая:
Чтобы научиться составлять такие уравнения, важно запомнить, что формулы аминокислот имеют единый план записи: слева записывается аминогруппа, справа — карбоксильная группа. Сущность реакции следующая: одна молекула аминокислоты предоставляет для образования пептидной связи аминогруппу, а другая — карбонильную. В результате реакции поликонденсации наряду с высокомолекулярными продуктом (дипептидом или полипептидом) образуется низкомолекулярное соединение (вода). Соединения, образовавшиеся при взаимодействии молекул аминокислот, называются пептиды (дипептиды, трипептиды и др.), в которых аминокислоты связаны между собой пептидной связью — СО—NH—, характерной и для белков, где эта группа является важной структурной единицей. Поскольку каждая аминокислота обладает по крайней мере двумя функциональными группами, то возможно дальнейшее присоединение к дипептиду новых молекул аминокислот. В результате образования каждой новой пептидной (амидной) связи выделяется молекула воды. В результате этой реакции синтезируются молекулы пептидов и полипептидов с болыийм числом аминокислотных звеньев. Белок представляет собой полипептид, содержащий сотни или тысячи аминокислотных звеньев. Пептиды — природные или синтетические вещества, молекулы которых построены из аминокислотных остатков, соединённых между собой пептидными связями. Они присутствуют во всех растительных и животных тканях. Белки — природные пептиды, содержащие большое число аминокислотных остатков (полипептиды) и обладающие сложной пространственной структурой. 3. Взаимодействие аминокислот со спиртами (с образованием сложных эфиров):
Основные понятия Аминокислоты • Изомерия • Амфотерность • Пептидная (амидная) связь, дипептид, полипептид • Белки Вопросы и задания
|
|
|



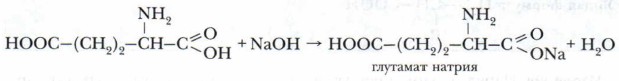
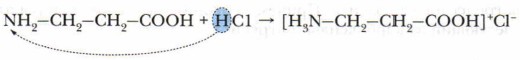
 Если в растворе устанавливается равновесие между ионной и молекулярной формами:
Если в растворе устанавливается равновесие между ионной и молекулярной формами:
 Какие реакции называются реакциями поликонденсации? Приведите пример.
Какие реакции называются реакциями поликонденсации? Приведите пример.
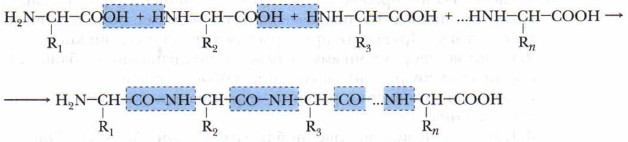
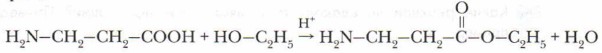
 1. На основании преобладания в молекуле амино- и карбоксильных групп аминокислоты подразделяют на нейтральные, осно́вные и кислотные. Приведите примеры для каждой из групп кислот.
1. На основании преобладания в молекуле амино- и карбоксильных групп аминокислоты подразделяют на нейтральные, осно́вные и кислотные. Приведите примеры для каждой из групп кислот.
 2. Пользуясь формулами аминокислот, приведёнными в таблице 20, составьте схему реакции получения любого трипептида.
2. Пользуясь формулами аминокислот, приведёнными в таблице 20, составьте схему реакции получения любого трипептида.
 4. В энциклопедии, выпущенной издательством «Аванта+» (Энциклопедия для детей, т. 17. Химия), в статье «Как устроена аминокислота» сказано: «Вся белковая жизнь на Земле — левая». Объясните, как это следует понимать.
4. В энциклопедии, выпущенной издательством «Аванта+» (Энциклопедия для детей, т. 17. Химия), в статье «Как устроена аминокислота» сказано: «Вся белковая жизнь на Земле — левая». Объясните, как это следует понимать.
 5. Используя Интернет, подготовьте мультимедийную презентацию на тему «Аминокислоты».
5. Используя Интернет, подготовьте мультимедийную презентацию на тему «Аминокислоты».